
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K + , Na + , Fe3 + , Mg2 + , Al3 + 等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是
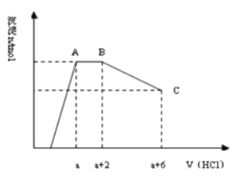
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K +
【答案】C
【解析】
试题分析:由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,则溶液中一定含OH﹣离子,与氢氧根离子不能共存的离子为Fe3 + 、Mg2 + 、Al3 + ,它们均不存在,随后反应生成沉淀逐渐增大,说明是溶液中的AlO2﹣、SiO32﹣和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2﹣与HCO3﹣发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3﹣;继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32﹣离子,反应完后继续加入盐酸,沉淀逐渐减小到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na + 离子、K+离子中的一种;A.溶液中硫酸根离子不能确定,则原溶液中不一定含有Na2SO4,A项错误;B.反应最后形成的溶液中的溶质为NaCl和AlCl3,B项错误;C.依据图象可知,和碳酸根离子反应的盐酸为2体积,CO32﹣ + 2H + =CO2↑ + H2O,氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3 + 3H + =Al3 + + 3H2O,原溶液中含有CO32﹣与AlO2﹣的物质的量之比为3:4,C项正确;D.依据判断原溶液中一定含有的阴离子是:OH﹣、SiO32﹣、AlO2﹣、CO32﹣,D项错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】医学研究表明,姜黄素具有降血脂、抗肿瘤、消炎、抗氧化等作用。姜黄素的合成路线如下所示:

已知信息:
①1mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3mol、2mol、1mol。

请回答下列问题:
(1)C物质的名称是_____________;J物质的分子式为______________;E到G的反应类型为______________。
(2)B中官能团的名称为_____________________;E物质的结构简式为________________。
(3)D与银氨溶液反应,再酸化可生成E;请写出此氧化过程的化学方程式:_____________________________________。
(4)写出2mol K物质和1mol![]() 转换为姜黄素的化学反应方程式:_____________________________________。
转换为姜黄素的化学反应方程式:_____________________________________。
(5)K的同分异构体中符合下列信息:
①含有苯环; ②苯环上只有两个支链; ③遇FeCl3溶液变色; ④含有![]() 结构。
结构。
符合上述条件的K的同分异构体有_____________________种。
(6)有机物L( )是一种重要的有机化合物。参照上述合成路线,补全以甲苯、
)是一种重要的有机化合物。参照上述合成路线,补全以甲苯、![]() 为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
为有机原料制备L的合成路线流程图(无机试剂任用) ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种有毒的气体,可用钢瓶储存,一旦氯气发生泄漏,必须采取果断措施,下列有关做法错误的是( )
A.人群向高处疏散
B.向泄漏地点撒一些石灰
C.用浸有弱碱性溶液的毛巾捂住口鼻
D.向泄漏地点喷酒食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物(a)![]() 、(b)
、(b)![]() 、(c)
、(c)![]() ,下列说法不正确的是
,下列说法不正确的是
A. a、b、c互为同分异构体
B. b的二氯代物有三种
C. 只有a不能发生加聚反应
D. 上述只有c的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关坐标图像错误的是( )
的是
A | B | C | D |
NaHSO4溶液中逐滴加入Ba(OH)2 溶液 | 向盐酸中滴入NaAlO2溶液 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
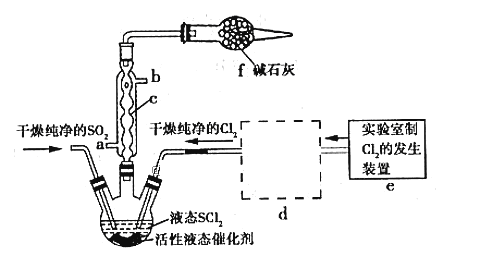
请回答下列问题:
(1)仪器c的名称是__________________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为_______________________
(3)已知SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是__________
(5)若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
B. 浓硫酸与单质碳反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
CO2↑+2SO2↑+2H2O,在此反应中,浓硫酸既表现了强氧化性又表现了酸性
C. 把足量铜粉投入到含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L
D. 常温下能够用铁、铝等容器盛放浓硫酸,是因为浓硫酸的强氧化性使其钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com