
下列有关物质氧化性或还原性强弱的叙述错误的是( )
A.Cl2、Br2、I2的氧化性能作为氯、溴、碘元素非金属性递变规律的判断依据[2014·福建理综,23(2)b]
B.同主族元素的简单阴离子还原性越强,水解程度越大(2013·天津理综,3C)
C.将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色,验证Br2的氧化性强于I2(2014·四川理综,4C)
D.将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置,下层溶液显紫红色,说明氧化性:Fe3+>I2(2014·广东理综,22D)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是 )。
| R | |||
| T | Q | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2 反应生成 CH4和H2O的热化学方程式 。(3分)
已知: ① CO(g)+H2O(g)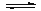 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g)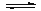 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g)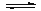 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
Ⅱ.电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
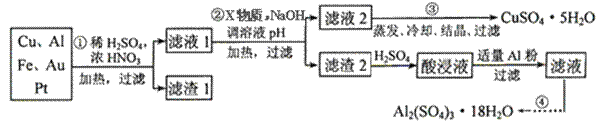
按要求回答下列问题:
(1)滤渣1中存在的金属有____________。(2分)
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)(1分)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。(2分)
(3)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:________________ (2分)
(4)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在 (填仪器名称)中加热脱水。(1分)
(5)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该
电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O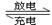 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,
该电池放电时负极反应式为 (3分),每有1mol K2FeO4被还原,转移电子的物质的量为 (1分),充电时阳极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应基本概念的相互关系
对于3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(1)Cu在反应中________电子,发生________反应,是________剂。
(2)HNO3在反应中________电子,被________,是________剂。
(3)该反应的氧化产物是________________,还原产物是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同物质的量的KClO3分别发生下述反应:①有催化剂MnO2存在时,受热分解得到氧气;②若不使用催化剂,加热至470 ℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是( )
A.都属于氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
用Pt电极电解含有Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则下列氧化性强弱的判断正确的是( )
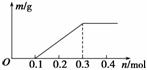
A.Cu2+>X3+>H+>X2+
B.X3+>H+>Cu2+>X2+
C.X3+>Cu2+>H+>X2+
D.X2+>H+>Cu2+>X3+
查看答案和解析>>
科目:高中化学 来源: 题型:
向KI溶液中逐滴加入少量CuSO4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析中不正确的是( )
A.充分反应后的溶液中无Cu2+存在
B.滴加CuSO4溶液时,每生成1 mol CuI会转移1 mol e-
C.根据上述实验现象可知:Cu2+比I2的氧化性强
D.通入SO2时发生反应的离子方程式为SO2+I2+2H2O===2HI+2H++SO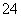
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为WO3(s)+3H2(g) W(s)+3H2O(g)。
W(s)+3H2O(g)。
请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2∶3,则H2的平衡转化率为
_______________。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
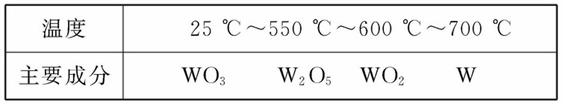
第一阶段反应的化学方程式为_____________________;
580 ℃时,固体物质的主要成分为_________________。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2(g) 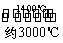 WI4(g)。下列说法正确的有________。
WI4(g)。下列说法正确的有________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
(1)平衡常数表达式中不出现固体和纯 液体;
液体;
(2)根据氢气和水蒸气的体积比可以求出反应的氢气的体积和反应前氢气的体积,从而可以计算氢气的转化率。
(3)根据表格中每一个温度段 的主要物质可以判断反应方程式、固体产物以及消耗氢气的量;
的主要物质可以判断反应方程式、固体产物以及消耗氢气的量;
(4)工业生产中向灯泡内充入碘单质之后,它与灯泡内壁上的钨在一定温度下反应生成碘化钨,碘化钨在灯丝上分解生成钨单质,反应体系为密 闭体系,反应又是可逆反应,因此碘单质可以循环利用。
闭体系,反应又是可逆反应,因此碘单质可以循环利用。
查看答案和解析>>
科目:高中化学 来源: 题型:
2 000 K时,反应CO(g)+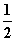 O2(g)
O2(g)
 CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)
CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)
 2CO(g)+O2(g)的平衡常数K′为( )
2CO(g)+O2(g)的平衡常数K′为( )
A.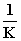 B.K2 C.
B.K2 C.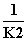 D.
D.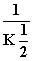
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com