
����Ŀ��MnSO4�ڹ�ҵ������ҪӦ�ã������̿���Ҫ�ɷ�ΪMnO2��ˮ������Fe2O3��FeO��Al2O3������PbO�����ʣ������Ʊ�MnSO4 �� ��������£� I�� �����̿���ͨ��SO2 �� �̡���������ǦԪ����������ʽ��������ý���Һ��pH��2��
II�� �����Һ�м�MnO2 �� ��ַ�Ӧ����ʯ���飬����ҺpH=4.7��
III���ټ��������������������ú���ˣ�
IV����Һ����Ũ������ȴ�ᾧ�����MnSO4���壮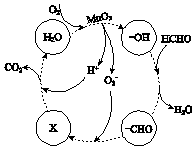
�����ϡ������������γ��������������pH
���� | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
��ʼ����ʱ��pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
��ȫ����ʱ��pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
��1��I�������̿���ͨ��SO2����MnSO4 �� �÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2��II �м���MnO2����ҪĿ����������Һ pH=4.7�����ɵij�����Ҫ���� ������CaSO4 ��
��3��III�м�������������������Ҫ��ȥ�������� ��
��4���ö��Ե缫���MnSO4��Һ�������Ƶø���MnO2 �� �ٵ��MnSO4��Һ�����ӷ���ʽ��
�ڸ���MnO2�����ڴ������ȩ���й����ı仯��ͼ��ʾ������X�� �� �ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��SO2+MnO2=MnSO4
��2����Fe2+����ΪFe3+�� Fe��OH��3��Al��OH��3
��3��Ca2+��Pb2+
��4��Mn2++2H2O ![]() MnO2+H2��+2H+�� HCO3���� HCHO+O2
MnO2+H2��+2H+�� HCO3���� HCHO+O2![]() CO2+H2O
CO2+H2O
���������⣺��1��I�������̿���ͨ��SO2����MnSO4��MnO2��SO2����������ԭ��Ӧ�Ļ�ѧ����ʽΪSO2+MnO2=MnSO4��
���Դ��ǣ�SO2+MnO2=MnSO4����2������������Fe2+���л�ԭ�ԣ����Ա�MnO2������������������Fe3+������ʯ���飬����pHֵ4.7��Fe3+��Al3+������ͨ����pHֵ��ת��Ϊ�����������������������������ɵij�����ҪΪFe��OH��3��Al��OH��3������CaSO4��
���Դ��ǣ���Fe2+����ΪFe3+��Fe��OH��3��Al��OH��3����3�������֪ͨ������III�õ�����ҺΪ���������ӵ���Һ�����ڴ˲����ʣ��Ľ������ӽ����˳��ӣ���������������������ȥCa2+��Pb2+��
���Դ��ǣ�Ca2+��Pb2+����4�����ö��Ե缫�������MnSO4��Һ���Ƶ�MnO2����������������Ӧ��Mn2+ʧȥ����ת��ΪMnO2������ˮ�õ��ӷ�����ԭ��Ӧ�����������ܷ�Ӧ���ӷ���ʽΪ��Mn2++2H2O ![]() MnO2+H2��+2H+��
MnO2+H2��+2H+��
���Դ��ǣ�Mn2++2H2O ![]() MnO2+H2��+2H+�����������멁CHOת��ΪX����X��H+����CO2��H2O����X��ʾ��������HCO3�������������Ǽ�ȩ�������ɶ�����̼��ˮ���ɵø÷�Ӧ���ܷ�Ӧ����ʽΪ��HCHO+O2
MnO2+H2��+2H+�����������멁CHOת��ΪX����X��H+����CO2��H2O����X��ʾ��������HCO3�������������Ǽ�ȩ�������ɶ�����̼��ˮ���ɵø÷�Ӧ���ܷ�Ӧ����ʽΪ��HCHO+O2 ![]() CO2+H2O��
CO2+H2O��
���Դ��ǣ�HCO3����HCHO+O2 ![]() CO2+H2O��
CO2+H2O��


 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ� ��
A.1����ϩ�ļ���ʽ�� ![]()
B.��ϩ�ķ���ʽ��CH2=CH2
C.��CHO�ĵ���ʽ�� ![]()
D.������ӵı���ģ��Ϊ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����������ʹ�õĽ���֮һ����������֪ʶ�ش��������⣺
��1�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壬д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ__________________________��
��2��ͭ����Ũ���ᷴӦ��д����Ӧ�Ļ�ѧ����ʽ_______________________;�����ɵ�����ͨ������ˮ��Һ�У�������Ϊ__________________________��
��3��ͭ����Ũ���ᷴӦ��д����Ӧ�����ӷ���ʽ___________________���ø�����Թܼ���NO2(��״���£���������ˮ���У���������Թ��ڵ���Һ����ɢ��ˮ���У����Թ������ʵ����ʵ���Ũ����______________________molL-1��
��4����ҵ�ϻ���ͭ�����з�������Ҫ��ӦΪ��2Cu2O+Cu2S=6Cu+SO2����������19.2 g Cuʱ����Ӧת�Ƶ���_________________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��� ![]() ��W�������еIJ��ֽṹ����һ����Ҫ�Ĺ��ܸ߷��Ӳ��ϣ��ۺ��� X�����е�һ�֣�ת��·����ͼ��
��W�������еIJ��ֽṹ����һ����Ҫ�Ĺ��ܸ߷��Ӳ��ϣ��ۺ��� X�����е�һ�֣�ת��·����ͼ�� 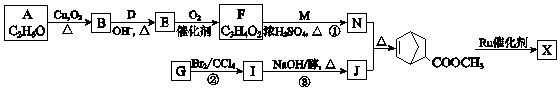
��֪��
i��R1CHO+R2CH2CHO ![]()
![]()
ii�� ![]()
iii��R1CH=CHR2+R3CH=CHR4 ![]() R1CH=CHR4+R3CH=CHR2
R1CH=CHR4+R3CH=CHR2
��R������������ԭ�ӣ�
��1��A�Ľṹ��ʽ�� ��
��2��B���������������� ��
��3��E�Ľṹ��ʽ�� ��
��4���ٵĻ�ѧ����ʽ�� ��
��5���ڵķ�Ӧ������ ��
��6��J����Ԫ��״������۵Ļ�ѧ����ʽ�� ��
��7��X�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����ӽ���Ĥ����ʯīΪ�缫��ⱥ��ʳ��ˮԭ��ʾ��ͼ����ͼ�ж�����˵������ȷ���ǣ� �� 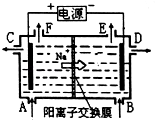
A.��״���£�����22.4LCl2��ͬʱ��2molNaOH����
B.��C����������NaOH��Һ
C.��E���ݳ���������H2
D.��F���ݳ���������Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫϡ��ҺX�������ܺ����±����������е�ij����
������ | H+��Na+��Al3+��Fe3+��NH4+��Mg2+ |
������ | OH-��CO32-��SiO32-��AlO2-��Cl- |
��ȡ��������Һ�������м���ij�Լ�Y�������������ʵ���(n)������Լ������(V)��ϵ��ͼ��ʾ��
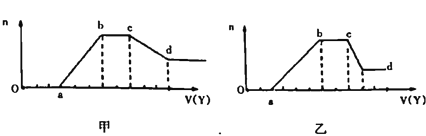
��1����Y�����������õ��Ĺ�ϵͼ���ͼ��ʾ����X��һ�����е���������______��X��һ�����ڵļ������������ʵ���֮��Ϊ____(����ɱ����������ӳ��ֵ�˳��д����˳��ab�η�����Ӧ�����ӷ���ʽΪ_________________��cd�η����ķ�Ӧ�����ӷ���ʽΪ______________��
��2����Y��NaOH��Һ�����õ��Ĺ�ϵͼ��������ʾ��X��һ�����е���������_______��ab�η�����Ӧ������________________��bc�η�����Ӧ������Ϊ________________��cd�η�����Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ������ͬϵ����ǣ� �� �� ![]() ��
�� ![]() ��
�� ![]() ��C2H4 ��CH2=CH��CH=CH2��C2H6��
��C2H4 ��CH2=CH��CH=CH2��C2H6��  ��
�� 
A.�ܺ͢�
B.�١��ں͢�
C.�ݡ��ߺ͢�
D.�͢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com