
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
分析 X、Y两元素可形成X2Y3型化合物,可判断X的可能化合价为+3价,Y的可能化合价为-2价,由此判断最外层电子.
解答 解:A.X为Al元素,Y为Cl元素,组成的化学为AlCl3,故A错误;
B.X的最外层电子排布为3s23p2,X为Si元素,Y的最外层的电子排布2s22p4,Y为O元素,可形成SiO2,故B错误;
C.当X的电子排布为3s23P1时,为Al元素,Y为S元素,能形成Al2S3型化合物,故C正确;
D.X为Mg元素,Y为N元素,形成化合物为X3Y2,不符合题意,故D错误.
故选C.
点评 本题考查原子核外电子排布,题目难度不大,注意根据化合物的类型判断可能的化合价,由此推断可能的核外电子排布.


科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 | |
| B. | NaCl的电子式: | |
| C. | F+的结构示意图: | |
| D. | Fe3+的最外层电子排布式为3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水属于化合物 | |
| B. | 一水合氨属于电解质 | |
| C. | 氨气溶于水时,只有极少数氨气与水结合生成一水合氨 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
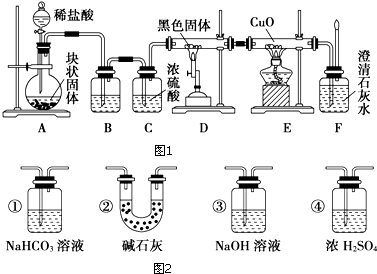
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
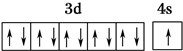 ,R在周期表中位于ds区.
,R在周期表中位于ds区.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
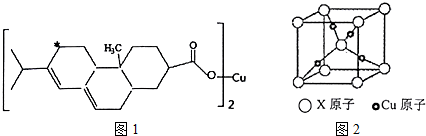
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
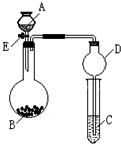 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com