

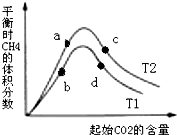
·ÖĪö ÓÉĶ¼1æÉÖŖ£¬X”¢YµÄÅØ¶Č±ä»ÆĮæÖ®±ČĪŖ2£ŗ1£¬ŌņXĪŖNO2”¢YĪŖN2O4£¬·¢Éś·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£®
£Ø1£©æÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬Ķ¬ÖÖĪļÖŹµÄÕżÄęĖŁĀŹĻąµČĒŅ±£³Ö²»±ä£¬ø÷×é·ÖµÄÅØ¶Č”¢ŗ¬Įæ±£³Ö²»±ä£¬ÓÉ“ĖŃÜÉśµÄĘäĖüŅ»Š©Įæ²»±ä£¬ÅŠ¶ĻĘ½ŗāµÄĪļĄķĮæÓ¦Ėę·“Ó¦½ųŠŠ·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»ŌŁ±ä»ÆĖµĆ÷µ½“ļĘ½ŗā£»
£Ø2£©·“Ó¦½ųŠŠµ½10minŹ±£¬²Ī¼Ó·“Ó¦µÄĖÄŃõ»Æ¶žµŖĪŖ1L”Į£Ø0.6-0.4£©mol/L=0.2mol£¬¹²ĪüŹÕČČĮæ11.38kJ£¬¹Ź·“Ó¦1molN2O4¹²ĪüŹÕČČĮæ11.38kJ”Į5=56.9kJ£¬×¢Ć÷ĪļÖŹµÄ¾Ū¼ÆדĢ¬Óė·“Ó¦Čȏ銓ČČ»Æѧ·½³ĢŹ½£»
£Ø3£©Ę½ŗāŹ±c£ØNO2£©=0.6mol/L”¢c£ØN2O4£©=0.4mol/L£¬“śČėK=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$¼ĘĖć£»
£Ø4£©·“Ó¦½ųŠŠµ½20minŹ±£¬ŌŁĻņČŻĘ÷ÄŚ³äČėŅ»¶ØĮæNO2£¬µČŠ§ĪŖŌŚŌĘ½ŗā»ł“”ÉĻŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÉś³ÉN2O4£Øg£©µÄ·½ĻņŅĘ¶Æ£¬Ę½ŗāŹ±NO2µÄĢå»ż·ÖŹż¼õŠ”£®
½ā“š ½ā£ŗÓÉĶ¼1æÉÖŖ£¬X”¢YµÄÅØ¶Č±ä»ÆĮæÖ®±ČĪŖ2£ŗ1£¬ŌņXĪŖNO2”¢YĪŖN2O4£¬·¢Éś·“Ó¦£ŗN2O4£Øg£©?2NO2£Øg£©£®
£Ø1£©A£®Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬ŗćĪĀŗćČŻĻĀ£¬ČŻĘ÷ÄŚŃ¹ĒæŌö“ó£¬Ń¹Ēæ²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹAÕżČ·£»
B£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬ĆܶČĪŖ³£Źż£¬ĆÜ¶Č²»±ä²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹB“ķĪó£»
C£®NO2ĪŖŗģ×ŲÉ«ĘųĢ壬N2O4ĪŖĪŽÉ«ĘųĢå£¬ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄŃÕÉ«²»Ėꏱ¼ä±ä»Æ¶ųøı䣬ĖµĆ÷¶žŃõ»ÆµŖµÄÅØ¶Č²»±ä£¬·“Ó¦µ½“ļĘ½ŗā£¬¹ŹCÕżČ·£»
D£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ėę·“Ó¦½ųŠŠ»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæŌö“ó£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ¼õŠ”£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±äĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹDÕżČ·£¬
¹ŹŃ”£ŗB£»
£Ø2£©·“Ó¦½ųŠŠµ½10minŹ±£¬²Ī¼Ó·“Ó¦µÄĖÄŃõ»Æ¶žµŖĪŖ1L”Į£Ø0.6-0.4£©mol/L=0.2mol£¬¹²ĪüŹÕČČĮæ11.38kJ£¬¹Ź·“Ó¦1molN2O4¹²ĪüŹÕČČĮæ11.38kJ”Į5=56.9kJ£¬¹ŹøĆ·“Ó¦ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN2O4£Øg£©?2NO2£Øg£©£¬”÷H=+56.9kJ/mol£¬
¹Ź“š°øĪŖ£ŗN2O4£Øg£©?2NO2£Øg£©”÷H=+56.9kJ/mol£»
£Ø3£©Ę½ŗāŹ±c£ØNO2£©=0.6mol/L”¢c£ØN2O4£©=0.4mol/L£¬ŌņĘ½ŗā³£ŹżK=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$=$\frac{0£®{6}^{2}}{0.4}$=0.9£¬
¹Ź“š°øĪŖ£ŗ0.9£»
£Ø4£©ŗćĪĀŗćČŻĻĀ£¬ŌŁ³äČėŅ»¶ØĮæNO2£¬µČŠ§ĪŖŌö“óŃ¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŠĀĘ½ŗāŗó»ģŗĻĘųĢåÖŠNO2µÄĢå»ż·ÖŹż¼õŠ”£¬¹ŹW1£¾W2£¬
¹Ź“š°øĪŖ£ŗ£¾£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖćÓėÓ°ĻģŅņĖŲ”¢»ÆŃ§Ę½ŗāדĢ¬ÅŠ¶Ļ”¢Ę½ŗā³£ŹżµČ£¬¹Ų¼üŹĒøł¾ŻÅØ¶Č±ä»ÆÅŠ¶ĻX”¢Y“ś±ķĪļÖŹ£¬ÄѶČÖŠµČ£®


 ĆūŠ£ĶØŠŠÖ¤ÓŠŠ§×÷ŅµĻµĮŠ“š°ø
ĆūŠ£ĶØŠŠÖ¤ÓŠŠ§×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ÓŠæĘѧ¼ŅĢį³ö”°ĀĢÉ«×ŌÓÉ”±µÄ¹¹Ļė£ŗ½«CO2±äĪŖČ¼ĮĻ»ņÓŠ»ś»Æѧʷ£®Ęä¹¹Ļė·Ö³É3øö²½Öč£ŗ
ÓŠæĘѧ¼ŅĢį³ö”°ĀĢÉ«×ŌÓÉ”±µÄ¹¹Ļė£ŗ½«CO2±äĪŖČ¼ĮĻ»ņÓŠ»ś»Æѧʷ£®Ęä¹¹Ļė·Ö³É3øö²½Öč£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆĪļÖŹA±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.6 mol•L-1•s-1 | |
| B£® | ÓĆĪļÖŹB±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ 0.6 mol•L-1•s-1 | |
| C£® | 2 s Ź±ĪļÖŹAµÄ×Ŗ»ÆĀŹĪŖ70% | |
| D£® | 2 s Ź±ĪļÖŹBµÄÅضČĪŖ 0.7 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄūÓĆ²¼ĄŹŌĖ¶ÆæÉĒų±šČÜŅŗŗĶ½ŗĢå | |
| B£® | ČÜŅŗÖŠĶعżŅ»Źų¹āĻߏ±Ć»ÓŠĆ÷ĻŌĻÖĻ󣬽ŗĢåÖŠĶعżŅ»Źų¹āĻߏ±³öĻÖĆ÷ĻŌµÄ¹āĀ· | |
| C£® | ½ŗĢåĪ¢Į£“ųµēŗÉ£¬ČÜŅŗÖŠČÜÖŹĪ¢Į£²»“ųµēŗÉ | |
| D£® | ÖʱøFe£ØOH£©3½ŗĢåµÄ·½·ØŹĒ£ŗ½«±„ŗĶFeCl3ČÜŅŗĶØČėČȵÄNaOHČÜŅŗÖŠ²¢³ÖŠųÖó·Š |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=5µÄH2SČÜŅŗÖŠ£ŗc£ØH+£©=c£ØHS-£©=1”Į10-5mol•L-1 | |
| B£® | ½«0.01 mo1•L-1µÄŃĪĖįÓė0.01 mo1•L-1°±Ė®µČĢå»ż»ģŗĻ£ŗc£ØNH4+£©=c£ØCl-£© | |
| C£® | ŌŚNa2CO3ČÜŅŗÖŠ£ŗc£ØOH-£©-c£ØH+£©=c£ØHCO3-£©+c£ØH2CO3£© | |
| D£® | ŌŚ0.1 mo1•L-1CH3COONaČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØCH3COO-£©£¾c£ØOH-£©£¾c£ØCH3COOH£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪļÖŹµÄĮæÅضČĻąµČµÄ¢ŁNH4C1”¢¢Ś£ØNH4£©2S04”¢¢ŪNH4HS04ČÜŅŗÖŠ£¬c£ØNH4+£©µÄ“óŠ”Ė³Šņ£ŗ¢Ś£¾¢Ū£¾¢Ł | |
| B£® | 0.2 mol•L-1CH3COOHČÜŅŗŗĶ0.2 mol•L-1CH3COONaČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØCH3COO-£©+c£ØOH-£©-c£ØH+£©=0.1 mol•L-1 | |
| C£® | pH=2µÄH2SO3ČÜŅŗÓėpH=12µÄNaOHČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØHSO3-£©£¾c£ØNa+£©£¾c£ØH+£©£¾c£ØOH-£© | |
| D£® | 0.1 mol•L-1NaHCO3ČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØHCO3-£©£¾c£ØOH-£©£¾c£ØCO32-£©£¾c£ØH2CO3£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com