
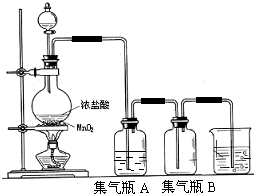
分析 实验室用加热浓盐酸与二氧化锰方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,通过盛有饱和食盐水的洗气瓶分别除去氯化氢,氯气密度大于空气密度,应选择向上排空气法收集,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
(1)氧化还原反应判断依据:有化合价变化;元素化合价升高的物质做还原剂;元素化合价降低的物质做氧化剂,浓盐酸与二氧化锰反应实质是酸性环境下二氧化锰氧化氯离子生成氯气,本身被还原为二价锰离子;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,结合氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,选择除杂试剂;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,依据方程式可知,反应中-1价氯元素化合价升高为氯气中0价,二氧化锰中+4价锰元素化合价降低为+2价,存在化合价升降为氧化还原反应,氯化氢为还原剂,二氧化锰为氧化剂,反应实质:酸性环境下二氧化锰氧化氯离子生成氯气,本身被还原为二价锰离子,离子方程式:4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O;
故答案为:是;二氧化锰;氯化氢;4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,结合氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,所以可以用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:氢氧化钠溶液;
点评 本题以实验室制备氯气为载体考查了氯气的制备、氧化还原反应基本概念,题目难度不大,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子有四个价电子 | B. | 碳原子彼此可结合成长链 | ||
| C. | 组成有机物的元素种类很多 | D. | 有机物容易形成同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙中滴入盐酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Fe(OH)3 中滴入硫酸 OH-+H +═H2O | |
| C. | AgNO3中滴入NaCl溶液 Ag ++Cl-═AgCl↓ | |
| D. | CO2通入到足量NaOH溶液中CO2+2OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7.0的降水通常称为酸雨 | |
| B. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| C. | 新制氯水经光照一段时间pH增大 | |
| D. | 测定氯水的pH应用干燥的pH试纸,不能用蒸馏水润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 事实 | 原因 | |
| A | 稀有气体的晶体属于原子晶体 | 其组成微粒是原子 |
| B | 键的极性H-O>H-S | 氧的电负性强于S的电负性 |
| C | HF稳定性比HI强 | HF分子间能形成氢键而HI不能 |
| D | 金刚石的熔沸点高于晶体硅 | C-C键能大于Si-Si键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com