
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á���ͼ��ʾһ�����أ� װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
����8�֣���X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ�����߸����뼸�η�̪��Һ����
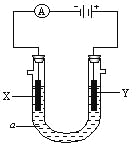
��������X���ϵĵ缫��Ӧʽ�� ��
��X�������۲쵽�������� ��
��Y�缫�ϵĵ缫��Ӧʽ�� ��
����õ缫��Ӧ����ķ����� ��
����6�֣���Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ����� ���缫��Ӧʽ��
��Y�缫�IJ����� ���缫��Ӧʽ��
��˵�������ʷ����ĵ缫��Ӧ����д����
���𰸡���1����2H++2e-====H2�� �ų����壬��Һ�����2Cl--2e-====Cl2�� ��ʪ��ĵ⻯�ص�����ֽ����Y�缫��������ֽ����ɫ
��2������ͭ Cu2++2e-====Cu ����ͭ Cu-2e-====Cu2+
��������
��1������X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��XΪ�������缫�������ӷŵ������������缫��ӦʽΪ2H++2e-=H2����ͬʱ�õ缫�����������������ӣ�������̪��Һ���죻��Y�缫�������ӷŵ������������缫��ӦʽΪ2Cl--2e-==Cl2�����������������ԣ����������������ɵⵥ�ʣ�����������Һ����ɫ����������������ʪ��ĵ��۵⻯����ֽ���飬����ʪ��ĵ���KI��ֽ����Y����������ֽ������˵��Y������ΪCl2����2������Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ������Ӧ���Ǵ�ͭ�������Ǵ�ͭ����X�缫�Ǵ�ͭ�������缫��ӦʽΪCu2++2e-==Cu����Y�缫�Ǵ�ͭ���缫��ӦʽΪCu-2e-==Cu2+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2���建����ͨ�뵽��KOH��Ba(OH)2��K[Al(OH)4]�Ļ����Һ��ֱ�����������ɳ��������ʵ�������ͨCO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����еĸ�����������ȷ����
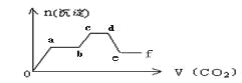
A. o��a�η�Ӧ�Ļ�ѧ����ʽ�ǣ�Ba(OH)2 + CO2 = BaCO3��+ H2O
B. b��c�η�Ӧ�����ӷ���ʽ�ǣ�2[Al(OH)4]��+ CO2 = 2Al(OH)3�� +CO32��+ H2O
C. a��b����c��d���������ķ�Ӧ��ͬ
D. d��e�γ����ļ���������̼�ᱵ�������ʧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��ԭ��������������B��Dͬ���壻X��Y��N�ֱ�������������Ԫ����������ɵĻ����Z������������Ԫ����ɵĻ������X��Y��Ħ��������ͬ��YΪ����ɫ���壬N��������Һ�壬��������֮���ת����ϵ��ͼ��ʾ(����������ʡ��)��������˵����һ����ȷ����( )

A. ��Է�������M>N���е�M>N
B. ԭ�Ӱ뾶��D>B>C>A
C. Z Ϊ NaOH
D. M�к��зǼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(�Ҷ���)������ԭ���ͳ����������ڽ������⡢֯��Ư��ϡ��������һ���Ʊ�����(��2���ᾧˮ)�Ĺ����������ң�

�ش��������⣺
��1��CO��NaOH��һ�������ºϳɼ����ơ������Ƽ�������Ļ�ѧ��Ӧ����ʽ�ֱ�Ϊ��__________________��_______________��
��2�����Ʊ������������ι��˲��������˲���������Һ��___________��������________�����˲���������Һ��____________��____________��������_______��
��3�����չ�������������Ŀ����______________��
��4�����˽�������������ֱ���������ữ�Ʊ����ᡣ�÷�����ȱ���Dz�Ʒ���������к��е�������Ҫ��____________________��
��5���ᾧˮ�ϲ����Ʒ�Ĵ����ø�����ط��ⶨ��
���������Ʒ0.250 g����ˮ����0.0500 mol��L-1������KMnO4��Һ�ζ�����dz�ۺ�ɫ�����ʣ�����KMnO4��Һ15.00 mL����Ӧ�����ӷ���ʽΪ__________________��
��ʽ����ó�Ʒ�Ĵ���____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ȼ�����һ����Ҫ�Ļ���ԭ�ϣ���ҵ����������ʯ�Ʊ���ˮ�Ȼ������������£���ش��������⣺

��1�� ʵ������,���Ƶ�Cl2�������____________�����������
��MnO2��Ũ�����Ϲ��� ��MnO2��NaCl��Ũ�����Ϲ���
��NaClO�������Ϲ��� ��Ư�ۺ������������
��2�� ���ձ���¯�в�����β��������װ����������___________�����������

��3��д������¯����Ӧ�Ļ�ѧ����ʽ_____________��
��4�������������Ĺ���������¯������¯�в�����SO2��Cl2�ȴ�����Ⱦ����������������һ������ͨ��ˮ�пɼ�����Ⱦ������Ƽ�ʵ���������Ƿ�ǡ����ȫ��Ӧ����Ҫ����ʵ�鲽�衢����ͽ���_____________��������ѡ����
�ɹ�ѡ���Լ����£�
���μӷ�̪������������Һ �ښ⻯������Һ �����軯����Һ ��Ʒ����Һ
��5��ijͬѧ���������װ����֤���������ijЩ��ѧ���ʡ�

�� ��˵������������������Ե�ʵ������Ϊ____________��
�� д��aƿ�з�����Ӧ�����ӷ���ʽ________________��
�� ��ַ�Ӧ��ȡaƿ�е���Һ�ֳ����ݣ��ֱ��������ʵ����
ʵ��I:���һ����Һ�м���������NaOH��Һ�����ɰ�ɫ������Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
ʵ��II:��ڶ�����Һ�м�������KMnO4��Һ����ɫ��ȥ��
ʵ��III:���������Һ�м���BaCl2��Һ�����ɰ�ɫ������
����ʵ�����ܳ��֤������������л�ԭ�Ե���__________����ʵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ャҺ��Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ2����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��͢��е����⡣

��������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1����Ӧ�������Լ�NaOH�ĵ���ʽΪ_________��B��C�ķ�Ӧ����Ϊ__________��C��Al���Ʊ�������Ϊ______________��
��2����С��̽����Ӧ�ڷ�����������D��Ũ�����ϣ������ȣ��ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�___________��
a���¶� b��Cl-��Ũ�� c����Һ�����
��3��0.1 mol Cl2�뽹̿��TiO2��ȫ��Ӧ������һ�ֻ�ԭ�������һ����ˮ���TiO2��xH2O��Һ̬���������4.28 kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
����Ԫ����Һ�ķ��������
��4���ö��Ե缫���ʱ��CrO42-�ܴӽ�Һ�з��������ԭ����__________�������Ԫ�ص�������_________�����������ɵ�����Ϊ___________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС����������˽�������ݣ�
�Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ������ˮ�����ڶ�Ԫ��ǿ�ᣨΪ������ʣ���������ǿ��̼�ᣬ���۵�Ϊ101.5�棬��157��������Ϊ̽������IJ��ֻ�ѧ���ʣ�����������ʵ�飺
��1����ʢ��1mL����NaHCO3��Һ���Թ��м��������Ҷ�����Һ���۲쵽����ɫ���ݲ������÷�Ӧ�����ӷ���ʽΪ________��
��2����ʢ���Ҷ��ᱥ����Һ���Թ��е��뼸�������ữ��KMnO4��Һ������������Һ���Ϻ�ɫ��ȥ����˵���Ҷ������______��������������������ԭ������������������������ƽ�÷�Ӧ�����ӷ���ʽ��_____MnO4-+____H2C2O4+___H+=___Mn2++____CO2��+_____H2O
��3����һ�������Ҷ�������Թ��У�����ͼ��ʾװ�ý���ʵ�飨�г�װ��δ�������

ʵ�鷢�֣�װ��C��G�г���ʯ��ˮ����ǣ�B��CuSO4��ĩ������F��CuO��ĩ��졣�ݴ˻ش�
������װ���У�D��������_________��
���Ҷ���ֽ�Ļ�ѧ����ʽΪ ________��
��4����С��ͬѧ��2.52g���ᾧ�壨H2C2O42H2O�����뵽100mL 0.2mol/L��NaOH��Һ�г�ַ�Ӧ����÷�Ӧ����Һ�����ԣ���ԭ����_______�������ּ�����������Һ�и����ӵ�Ũ���ɴ�С��˳��Ϊ��_______�������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����O2��CH4��Na2O2�����ܱ������У���250�����õ��������ѧ��Ӧ����Ӧֹͣ��ʹ�����ڻָ���250�棬�����ڵ���ѹΪ�㡣�ɴ˵ó��Ľ�����ȷ����(����)
A. ԭO2��CH4��Na2O2���ʵ���֮��Ϊ1��2��6����Ӧ�����������ɵĹ�����Na2CO3��NaHCO3
B. ԭO2��CH4��Na2O2���ʵ���֮��Ϊ2��1��4����Ӧ�����������ɵĹ�����Na2CO3��NaOH
C. ԭO2��CH4��Na2O2���ʵ���֮��Ϊ1��2��6����Ӧ�����������ɵĹ�����Na2CO3��NaOH
D. ԭO2��CH4��Na2O2���ʵ���֮��Ϊ2��1��4����Ӧ�����������ɵĹ�����NaHCO3��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�����ʵ�ķ���ʽ����ȷ����
A. ��������������ʴʱ���������������� Fe��2e- = Fe2+
B. Na2CO3 ��Һ�Լ��� CO32��+2H2O ![]() H2CO3 + 2OH��
H2CO3 + 2OH��
C. ����ͨ��NaOH��Һ�õ�Ư��Һ Cl2 + 2OH�� = Cl�� + ClO�� + H2O
D. ��Mg(OH)2����Һ�еμ�FeCl3��Һ������Fe(OH)3 ��3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3��+3Mg2+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com