
利用零价铁(ZVI)处理水体砷污染的原理为:零价铁被氧化腐蚀得到水合氧化铁,[Fe(OH)3和 FeOOH,可分别写为Fe2O33H2O和Fe2O3H2O统称水和氧化铁],水合氧化铁再吸附沉降砷的化合物(如:含AsO43 - 、AsO33 - 等物质)。
(1)写出单质铁在水体中被(O2)氧化腐蚀得到水和氧化铁(FeOOH)的化学方程式: 。
(2)某课题组通过查阅文献,进行了用相同单质铁(相同性状和相同质量)在相同时间内,对影响零价铁去除水体中砷的效率的因素提出以下假设,并进行了实验探究:
假设1: ;
假设2:水体中所含其他物质及离子;
假设3:水体中的溶解氧;
(3)其他条件相同,调节水样的pH,得到除砷效率曲线为图1,若控制水样pH=5时,测定不同时间段的除砷效率为图2:
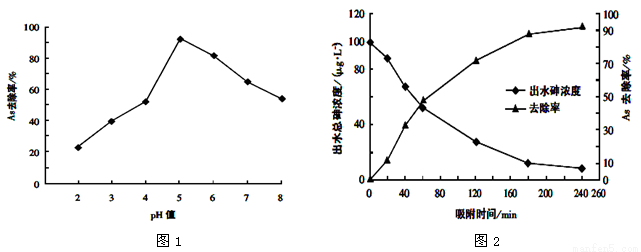
①根据单质铁除砷原理,请解释水样酸性较强时,除砷效率较低的原因可能是_____________;
②国家饮用水标准规定水中砷的含量应低于0.05mg/L(1mg=1000μg),根据图中信息判断:若控制水样的pH=6,出水后的砷浓度是否达到饮用水标准?_______。(填“达到”、“未达到”或“无法判断”)
(4)为验证假设3,课题组成员设计了以下实验。请你完成表格中的内容(水样中砷的浓度可用分光光度计测定)
实验步骤 | 预期实验结果和结论 |
①取一定体积废水样品,分成体积相同两份,其中一份持续通入一段时间_________,以减少水中的溶解氧; | ___________________,则溶解氧对砷的去除效率有影响;反之则无影响。 |
②___________________________________ ______________________________________ | |
③___________________________________ ______________________________________ |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:2014-2015学年北京市东城区高三综合能力测试二理综化学试卷(解析版) 题型:选择题
现有常温下水电离出的c(H+)均为1×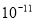 mol/L的4种溶液:
mol/L的4种溶液:
①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水。
有关上述溶液的比较中,正确的是
A.向等体积溶液中分别加水稀释100倍后,溶液的pH:③>④>②>①
B.等体积的①、②、③溶液分别与足量铝粉反应,生成H2的量①最小
C.②、③溶液等体积混合后,溶液显碱性
D.①、④溶液混合若pH=7,则消耗溶液的体积:④>①
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省达州市高一3月月考化学试卷(解析版) 题型:选择题
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→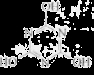 +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
aXn-和bYm+为两主族元素的离子, 它们的电子层结构相同, 下列判断错误的是
A.原子半径X<Y B.a+n=b-m
C.离子半径X n-<Y m+ D.X的氢化物的化学式为HnX
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
关于化学键的下列叙述中,正确的是
A.离子化合物中可能含离 子键 B.共价化合物中可能含离子键
子键 B.共价化合物中可能含离子键
C.离子化合物中不含共价键 D.共价化合物中不含离子键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
锂离子电池种类很多,其中有一种锂电池,用金属锂和石墨做电极材料,电解质溶液时由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)而形成的,电池总反应为8Li+3SOCl 2=6LiCl+Li 2 SO 3 +2S则下列叙述中错误的
A.电解质溶液中混入水,会影响电池反应
B.反应中亚硫酰氯既是溶剂,又是氧化剂
C.电池工作(放电)过程中,亚硫酰氯(SOCl2) 被还原为Li 2 SO 3
D.电池工作过程中,金属锂提供的电子与正极生成的硫物质的量之比为4:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:填空题
(16分)(一)在温度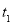 和
和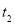 下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
(1)已知t2>t1,生成HX的反应是 反应(填“吸热”或“放热”)。
(2)用电子式表示HCl的形成过程 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 (用化学式表示)。
(4)K的变化体现出X2化学性质的递变性,用原子结构解释原因是 。
(二)下图表示一些晶体结构,它们分别是晶体干冰、金刚石、氯化铯、氯化钠某一种的某一部分。
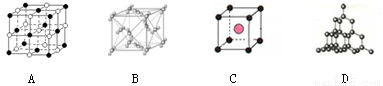
(5)代表金刚石的是 (选填字母);晶体中碳原子与C—C键数目之比是 。
(6)上述B、C、D三种物质熔点由高到低的排列顺序为 (用字母表示)。
(7)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<,>或=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是周期表前20号元素,它们的原子序数依次增大,X与R,Y与W分别同主族,Z原子最外电子数是W原子最外层电子数的一半,X与Y可形成X2Y和X2Y2两种液态化合物。下列说法不正确的是
A.25℃时0.1mol/LX2W溶液的pH>1-lg2
B.溶液中水的电离程度:RYX>R2W
C.热稳定性:X2Y>X2W
D.由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com