
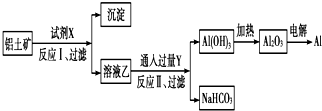
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |
分析 综合分析工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液A为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,电解熔融Al2O3属于氧化还原反应,以此解答该题.
解答 解:综合分析工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液A为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,电解熔融Al2O3属于氧化还原反应,
A.分离氧化铝和氧化铁,只能用氢氧化钠溶液,不可能用酸,因氧化铝与氢氧化钠反应,氧化铁不反应,但二者都可与酸反应,故A正确;
B.铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C.结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C正确;
D.Al活泼性较强,在考虑成本的情况下,没有合适的还原剂可用于冶炼铝,工业用电解法,故D错误.
故选D.
点评 本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3与盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能 | |
| D. | 该反应的反应物和生成物的能量高低与醋酸的凝固无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该图表示的是“节能减排”中的节能标志 | |
| B. | 加快化石燃料的开采与使用,停止使用核能 | |
| C. | 安装煤炭“固硫”、“脱硝”装置,降低酸雨发生率 | |
| D. | 推广农作物的生物防治技术,减少农药的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
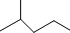 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ds原子在周期表中位于第7周期第ⅦB族 | |
| B. | Ds是过渡元素 | |
| C. | Ds原子的核外电子数为110 | |
| D. | Ds为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 指示剂 | 石蕊 | 甲基橙 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 8.2-10.0 |
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20 | 0.50 | 25.12 | 24.62 |
| 2 | 20 | 如图 | 如图 | 填写24.60 |
| 3 | 20 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应只是三氯甲烷、四氯甲烷的混合物 | |
| C. | 已知HCl可降低NaCl的溶解度,故水槽中有固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com