


科目:高中化学 来源: 题型:
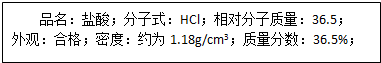
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
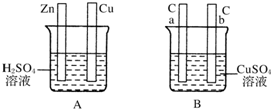 对如图中电极加以必要的连接并填空:
对如图中电极加以必要的连接并填空:查看答案和解析>>
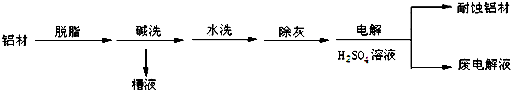
科目:高中化学 来源: 题型:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | 20~30mg/1Kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
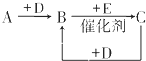 A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成.A、B、C相互转化关系如图所示(部分产物已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com