
| 7.4-5.8 |
| 16 |
| 74 |
| 12��4+1��10+16��1 |
 ��
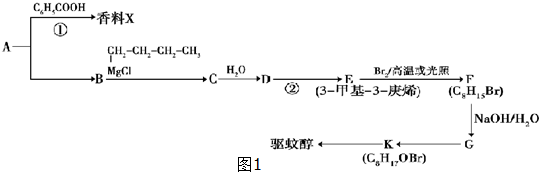
��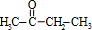 ���ɷ�Ӧ��Ϣ��֪��
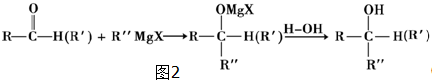
���ɷ�Ӧ��Ϣ��֪��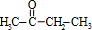 ��CH3CH2CH2CH2MgCl�����ӳɷ�Ӧ����C��C��ˮ������D����DΪCH3C��OH����C2H5��CH2CH2CH2CH3��D������ȥ��Ӧ����E��3-��-3-��ϩ����E�ṹ��ʽΪCH3CH2C��CH3��=CHCH2CH2CH3��
��CH3CH2CH2CH2MgCl�����ӳɷ�Ӧ����C��C��ˮ������D����DΪCH3C��OH����C2H5��CH2CH2CH2CH3��D������ȥ��Ӧ����E��3-��-3-��ϩ����E�ṹ��ʽΪCH3CH2C��CH3��=CHCH2CH2CH3��| 7.4-5.8 |
| 16 |
| 74 |
| 12��4+1��10+16��1 |
 ��
��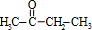 ���ɷ�Ӧ��Ϣ��֪��
���ɷ�Ӧ��Ϣ��֪��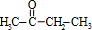 ��CH3CH2CH2CH2MgCl�����ӳɷ�Ӧ����C��C��ˮ������D����DΪCH3C��OH����C2H5��CH2CH2CH2CH3��D������ȥ��Ӧ����E��3-��-3-��ϩ����E�ṹ��ʽΪCH3CH2C��CH3��=CHCH2CH2CH3��
��CH3CH2CH2CH2MgCl�����ӳɷ�Ӧ����C��C��ˮ������D����DΪCH3C��OH����C2H5��CH2CH2CH2CH3��D������ȥ��Ӧ����E��3-��-3-��ϩ����E�ṹ��ʽΪCH3CH2C��CH3��=CHCH2CH2CH3�� �뱽���ᷢ��������Ӧ����
�뱽���ᷢ��������Ӧ���� ����Ӧ����ʽΪ��
����Ӧ����ʽΪ�� +
+
| ŨH2SO4 |
| �� |
 +H2O��
+H2O�� +
+
| ŨH2SO4 |
| �� |
 +H2O��
+H2O��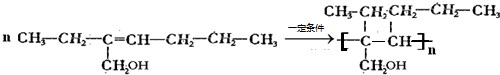 ��
��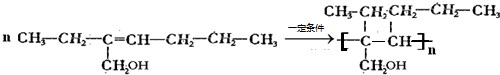 ��
�� ����ͬ���칹����������Ϊ��ͬ���ţ���1mol�л������2mol��������ˮ��Һ��ȫ��Ӧ�õ������л������ȡ����Ϊ-OOCCH2CH3��2��-CH3��-OOCH��2��-CH2CH3����2��-CH3���ڣ�-OOCCH2CH3��2��λ�ù�ϵ����2��-CH3��䣬-OOCCH2CH3��3��λ�ù�ϵ����2��-CH3��ԣ�-OOCCH2CH3��1��λ�ù�ϵ������6��ͬ���칹�壬ͬ��ȡ����Ϊ-OOCH��2��-CH2CH3����6��ͬ���칹�壬���Է���������ͬ���칹����12�֣�����һ��Ϊ
����ͬ���칹����������Ϊ��ͬ���ţ���1mol�л������2mol��������ˮ��Һ��ȫ��Ӧ�õ������л������ȡ����Ϊ-OOCCH2CH3��2��-CH3��-OOCH��2��-CH2CH3����2��-CH3���ڣ�-OOCCH2CH3��2��λ�ù�ϵ����2��-CH3��䣬-OOCCH2CH3��3��λ�ù�ϵ����2��-CH3��ԣ�-OOCCH2CH3��1��λ�ù�ϵ������6��ͬ���칹�壬ͬ��ȡ����Ϊ-OOCH��2��-CH2CH3����6��ͬ���칹�壬���Է���������ͬ���칹����12�֣�����һ��Ϊ �ȣ�
�ȣ� ��
��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Bacl2 |
| �� |
| NaOH |
| �� |
| Na2CO3 |
| �� |
| HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ܻ���DEHP��ָ�ڱ����������2���һ�������������������������ʳƷ���Ӽ� |
| B����������������ѹ������ɫҺ��Ϊ�����仯 |
| C��Na2O?SiO2��һ�ּĹ����Σ�������ˮ |
| D��Ϊ�ⶨ�����������Ƶĵ����ԣ��ɽ��������ƹ������ʯӢ�����м����ۻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ۺ���ά�ؾ�Ϊ�߷��ӻ�������߶��ǹ�ҵ����ƾ���ԭ�� |
| B��CH2=CH-CH��CH3��-C��CH�������������3-������ |
| C���������ļ��顢�Ҵ�����ȩ�ֱ���ȼ�գ������������������μ��� |
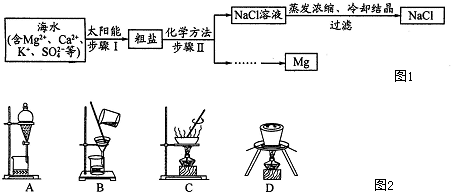
D����֪ƻ����Ľṹ��ʽΪ ��������ʿɷ���������Ӧ��������Ӧ�����۷�Ӧ����HOOC-CH2-CH��OH��-COOH��Ϊͬ���칹�� ��������ʿɷ���������Ӧ��������Ӧ�����۷�Ӧ����HOOC-CH2-CH��OH��-COOH��Ϊͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ȫ���ܽ�ʱ�ռ���NO��������Ϊ2.24L����״���� |
| B�������ɳ����������ʱ������NaOH��Һ�����СΪ100mL |
| C��ԭϡ��������ʵ���Ũ��һ��Ϊ4mol/L |
| D���μӷ�Ӧ������������m��Ϊ9.6g��m��3.6g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A��pH=7��ѪҺ�У�c��HCO3-����c��H2CO3�� | ||||
| B���������������巢�����ж�ʱ��c��H+��?c��OH-����� | ||||
| C�����巢�����ж�ʱ���ɾ�����עһ��Ũ�ȵ�NaHCO3��Һ�ⶾ | ||||
D��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ʵ������ | ʵ��Ŀ�Ļ���� |
| A | ��ij��Һ�м���ϡ���ᣬ�ų���ɫ�ݼ�����ζ�� �壮������ͨ�˳���ʯ��ʯ��ˮ����� | ֤���ø�Һ�д���SO 32- |
| B | ��NaOH��Һ���˸���Һ�м���?�ų���������ʹʪ��ĺ�ɫʯ����ֽ���� | ֤����Һ����NH4+ |
| C | ��Cl2��ͨ��Ʒ����Һ�У�Ʒ����Һ��ɫ | ֤��Cl2�Ļ��� |
| D | ��ع���ữ��H2O2��Һ����Fe��NO3��2��Һ�У���Һ���ɫ | ֤�������ԣ�H2O2��Fe3+ ǿ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com