
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO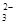 和OH- 和OH- |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
 NaHCO3+NaOH。因此溶液中的阴离子有CO
NaHCO3+NaOH。因此溶液中的阴离子有CO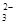 和OH-及HCO3-。错误。B.在NaHCO3溶液中:根据电荷守恒可得c(H+)+c(Na+) =c(OH-)+2c(CO
和OH-及HCO3-。错误。B.在NaHCO3溶液中:根据电荷守恒可得c(H+)+c(Na+) =c(OH-)+2c(CO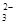 )+c(HCO3-);根据物料守恒可得c(Na+)= c(CO
)+c(HCO3-);根据物料守恒可得c(Na+)= c(CO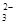 )+c(HCO3-)+c(H2CO3)。两式相减可得c(OH-)+c(CO
)+c(HCO3-)+c(H2CO3)。两式相减可得c(OH-)+c(CO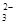 )= c(H+)+c(H2CO3)。错误。C两溶液混合后得到的为等物质的量的CH3COOH与CH3COONa的混合物。根据元素守恒可得c(CH3COO-)+c(CH3COOH)= 0.10mol/L.正确。D.由于HCl是强酸,完全电离所以c(HCl)=c(H+);醋酸是弱酸,部分电离,c(CH3COOH)>> c(H+)。所以在体积与pH都相同的HCl溶液和CH3COOH溶液中含有的溶质的物质的量n(CH3COOH)>>n(HCl)因此所消耗的NaOH物质的量CH3COOH多。错误。
)= c(H+)+c(H2CO3)。错误。C两溶液混合后得到的为等物质的量的CH3COOH与CH3COONa的混合物。根据元素守恒可得c(CH3COO-)+c(CH3COOH)= 0.10mol/L.正确。D.由于HCl是强酸,完全电离所以c(HCl)=c(H+);醋酸是弱酸,部分电离,c(CH3COOH)>> c(H+)。所以在体积与pH都相同的HCl溶液和CH3COOH溶液中含有的溶质的物质的量n(CH3COOH)>>n(HCl)因此所消耗的NaOH物质的量CH3COOH多。错误。

科目:高中化学 来源:不详 题型:填空题
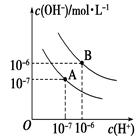
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2- H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是
Co2+(粉红色)+4Cl-,向氯化钴稀溶液中加入一定量的浓盐酸,溶液的颜色变化是| A.由蓝色变为粉红色 | B.红色加深 |
| C.由粉红色变为蓝色 | D.蓝色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++HS-和HS-
H++HS-和HS- H++S2-若向H2S溶液中
H++S2-若向H2S溶液中| A.加水,平衡向右移动,溶液中氢离子浓度增大 |
| B.通入过量SO2气体,平衡向左移动,溶液pH值增大 |
| C.滴加新制氯水,平衡向左移动,溶液pH值减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
 Na2CO3 + 2HClO
Na2CO3 + 2HClO NaCN+ NaHCO3
NaCN+ NaHCO3查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中粒子的数目减小 |
| B.再加入CH3COONa固体能促进醋酸的电离 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
D.溶液中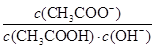 不变 不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl是弱电解质 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com