
【题目】某中学探究性学习小组拟用锌粒与足量稀盐酸反应测定通常状况(约20 ℃,1 atm)下H2的气体摩尔体积。设计实验装置和实验步骤如下:
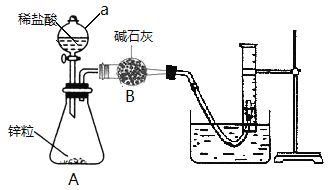
①连接如图所示装置,并检查装置的气密性
②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
③称取A装置和B仪器和药品的总质量,记为m g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为n g;
⑦处理数据等。
(1)仪器a的名称为_____________。
(2)写出锥形瓶中发生反应的离子方程式____________________________________________________________。
(3)写出检查装置A气密性的方法______________________________________________________________________。
(4)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=__________________________L·mol-1(用含m、b、n等字母的代数式表示)。
(5)若拆除B仪器(其他仪器不变),_______________________________(填“会”或“不会”)对本实验产生影响,理由是______________________________________________________________________________________________。
【答案】 分液漏斗 Zn+2H+=Zn2++H2↑ 关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好 Vm=2b×10-3/(m-n)L·mol-1 会 H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响
【解析】(1)根据装置图可知仪器a的名称为分液漏斗;(2)锥形瓶中发生反应中利用盐酸与锌发生置换反应生成氢气和氯化锌,反应的方程式为Zn+2HCl═ZnCl2+H2↑;(3)根据压强差的原理可以检查该装置气密性,具体操作为关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;(4)根据上述数据可知,氢气的体积为b mL,氢气的质是为mg-ng,所以氢气物质的量为![]() mol,H2的摩尔体积Vm=
mol,H2的摩尔体积Vm= mol=
mol=![]() L/mol;(5)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响。
L/mol;(5)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致n偏小,对实验产生影响。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的钠铝合金置于水中,合金全部溶解,得到 20mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示:

写出有关反应的化学方程式:
(1)______________________________ ;(2)______________________________;
(3)______________________________ ;(4)____________________________ ;
(5)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4易溶于水,其水溶液呈酸性,有毒。主要用于电镀工业,也是金属镍离子的来源。NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

(1)NiSO4水溶液呈酸性原因是_________________________;
(2)向滤液Ⅱ中加入H2O2的离子方程式:_________________________;
(3)调滤液ⅡpH的目的是除去Fe3+,原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______;
(5)从d(NiSO4溶液)经______、______、______洗涤、干燥等操作可得到NiSO4·6H2O晶体;
(6)为了提高产率,分离得到NiSO4·6H2O后剩余液体要循环使用,则应该回流到流程中的______位置(填a、b、c、d)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g); ΔH = -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); ΔH = -483.6KJ·moL-1
H2O (g)=H2O(l); ΔH = -44.0KJ·moL-1
(1)氢气燃烧热ΔH=__________;
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式______________。
(3)往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为________;反应达到平衡后,升高温度,此时平衡常数将____(填“变大”、“不变”或“变小”)。
(4)从汽车尾气中分离出CO与O2、熔融盐Na2CO3组成的燃料电池,同时采用电解法制备N2O5,装置如图所示,其中Y为CO2。写出石墨I电极上发生反应的电极反应式_______________________________。在电解池中生成N2O5的电极反应式为__________________________________。

(5)在一定条件下,用NH3处理汽车尾气中的NO。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的一氯代物的数目大小排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3 ②(CH3)3CCH(CH3)CH2CH3
③(CH3)3CCH2CH3 ④(CH3)3CCH2C(CH3)3
A. ①>②>③>④ B. ③>②>④>①
C. ③=①>②>④ D. ②>③=①>④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com