
| A. | 2a | B. | 2a+2 | C. | 2a+10 | D. | a+2 |
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Z的气态氢化物和最高价氧化物的水化物水溶液均呈酸性 | |
| B. | X、Y、Z三种元素组成的化合物,其化学式为Y(ZX3)3 | |
| C. | 元素Z可组成由共价键构成的单质 | |
| D. | X、Y两种元素构成一种阴离子,该阴离子与酸反应时,可能变成Y的阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

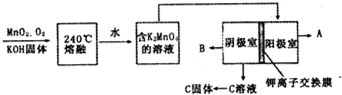
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.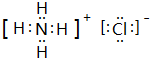 ,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
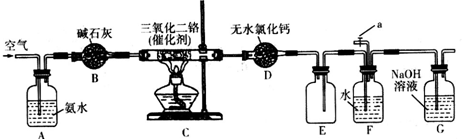
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com