
| A. | 只能是离子化合物X2Y | |
| B. | 只能是共价化合物X2Y2 | |
| C. | 既可能是离子化合物也可能是共价化合物 | |
| D. | 形成的化合物无论是X2Y还是X2Y2 原子都达到了8电子稳定结构 |
分析 X元素的原子最外层有1个电子,处于IA则,Y元素的原子最外层有6个电子,处于ⅥA族,可以形成H2O、Na2O、H2O2、Na2O2等化合物,据此分析解答.
解答 解:X元素的原子最外层有1个电子,处于IA则,Y元素的原子最外层有6个电子,处于ⅥA族,可以形成H2O、Na2O、H2O2、Na2O2等化合物.
A.可以形成Na2O2等离子化合物,故A错误;
B.可以形成H2O2等共价化合物,故B错误;
C.H2O、H2O2等为共价化合物,Na2O、Na2O2等为离子化合物,故C正确;
D.H2O、H2O2等为共价化合物,含有H元素,一定不满足8电子结构,故D错误,
故选C.
点评 本题考查原子结构与元素性质,难度不大,判断元素所处主族,再结合常见元素化合物进行解答,注意列举法的应用.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
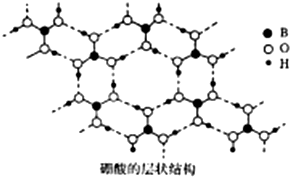 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 引进电动汽车,减少汽车尾气排放 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 积极推行和使用能被微生物降解的新型聚合物材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和碱发生中和反应时放出的热量不一定是57.3KJ | |
| B. | 酸和碱发生中和反应时所放出的热量就叫中和热 | |
| C. | 在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热 | |
| D. | 中和热不包括物质溶解、电离、水合等过程中的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①④⑥ | C. | ②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO- Na+ NO3- Cl- | B. | K+ Na+ Cl- NO3- | ||
| C. | K+ Na+ Cl- AlO2- | D. | K+ I- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com