
 或
或 .
.分析 由元素周期表的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)具有相同电子结构的离子中,核电荷数越大离子半径越小;
(2)元素的非金属性越强,对应的高价氧化物对应水化物的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH;
(4)过氧化氢在二氧化锰或氯化铁催化作用下分解生成氧气;
(5)非金属性越强,对应氢化物越稳定.
解答 解:由元素周期表的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)④、⑤、⑥的离子半径由大到小的顺序为O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(2)②⑦是C、Si,是同主族元素,根据元素周期律:从上到下最高价氧化物对应水化物的酸性逐渐减弱,H2CO3>H2SiO3,③为N,非金属N>C,元素的非金属性越强,对应的高价氧化物对应水化物的酸性越强,所以酸性:HNO3>H2CO3,故答案为:HNO3>H2CO3>H2SiO4;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等,对应的电子式分别为 、
、 ,故答案为:
,故答案为: 或
或 ;
;
(4)过氧化氢在二氧化锰或氯化铁催化作用下分解生成氧气,B、C均与过氧化氢发生氧化还原反应,故答案为:AD;
(5)非金属性O>N>C,对应氢化物的稳定性为H2O>NH3>CH4,故答案为:H2O>NH3>CH4.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
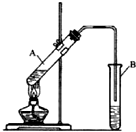 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的速率主要取决于①的快慢 | |
| B. | NOBr2是该反应的催化剂 | |
| C. | 正反应的活化能比逆反应的活化能小a kJ•mol-1 | |
| D. | 增大Br2(g)浓度能增大活化分子百分数,加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CuSO4•5H2O的质量为250g/mol | |
| B. | 125g CuSO4•5H2O的物质的量为0.5 mol | |
| C. | CuSO4•5H2O的摩尔质量为250g | |
| D. | 配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4•5H2O 1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C可用于考古断代,推算出文物的年代 | |
| B. | 在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距 | |
| C. | 道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| D. | 确定物质中含有哪些金属元素可用原子吸收光谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com