
分析 (1)①根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作;
②氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性或碱性变色范围内的指示剂;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)根据C(HCl)=$\frac{c(NaOH)×V(NaOH)}{V(HCl)}$分析.
(3)根据关系式 H2SO4~2NaOH来计算出 H2SO4的浓度.
解答 解:(1)①中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是B C E D A F;
故答案为:B C E D A F;
②氢氧化钠与HCl恰好中和溶液的pH为7,可选择酸性变色范围内的指示剂甲基橙,也可选择碱性变色范围内的指示剂酚酞;
故答案为:甲基橙或酚酞;
③用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色,则到达滴定终点;用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:用甲基橙作指示剂时,溶液由橙色变黄色,且半分钟内不变色或用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色;
(2)根据C(HCl)=$\frac{c(NaOH)×V(NaOH)}{V(HCl)}$分析,配制标准溶液的氢氧化钠中混有Na2CO3杂质,导致所用氢氧化钠溶液体积偏大,故①偏高;
滴定终点读数时,俯视滴定管的刻度,其读数偏少,V(NaOH)偏少,故②偏低;
盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,故③无影响;
滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,V(NaOH)偏高,故④偏高;
滴定前碱式滴定管尖嘴部分未充满溶液,导致V(标准)偏大,故⑤偏大,
滴定中不慎将锥形瓶内液体摇出少量于瓶外,导致所用氢氧化钠体积增少,故⑥偏低.
故答案为:①④⑤;
(3)滴定消耗的标准液的体积为:15.00mL,
H2SO4 ~2NaOH
1 2
c(H2SO4)×$\frac{1}{100}$×25.00mL 0.14mol/L×10.00mL;
解得:C(H2SO4)=4.20mol•L-1,
故答案为:4.20.
点评 本题考查了酸碱中和滴定操作、计算及误差分析,题目难度中等,注意掌握中和滴定的操作方法、滴定终点的判断方法、滴定误差的分析方法与技巧,试题有利于培养学生灵活应用所学知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
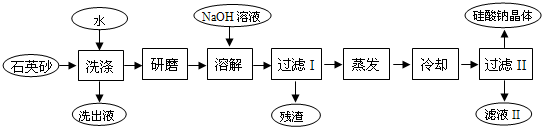
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
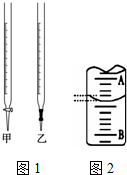 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com