
| A. | 反应过程中,化合价发生变化的元素是镍、镧 | |
| B. | 该电池放电时,负极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O | |
| C. | 市面上出售的标称容量为 2000 mA•h的1节镍氢电池至少应含有镧镍合金5.4 g(已知 1法拉第电量为96500库仑或安培•秒) | |
| D. | 充电电池放电后可以再充电使活性物质获得再生,但实际上充放电次数仍有限制 |
分析 A、此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O,所以化合价发生变化的元素是镍、氢;
B、此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O;
C、根据1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mAh的1节镍氢电池则要转移$\frac{2000×3600}{96500}$×10-3mol电子,再根据电极反应计算需要镧镍合金的质量;
D、二次电池放电后可以充电重新使用,使活性物质获得再生,但实际上充放电次数仍有限制.
解答 解:A、此电池放电时的反应为LaNi5H6+6NiOH=LaNi5+6Ni(OH)2,正极反应为6NiOOH+6e-=6Ni(OH)2+6OH-,负极反应为 LaNi5H6-6e-+6OH-=LaNi5+6H2O,所以化合价发生变化的元素是镍、氢,故A错误;
B、放电时,负极失电子发生氧化反应,电极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O,故B正确;
C、因为1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mA•h的1节镍氢电池则要转移$\frac{2000×3600}{96500}$×10-3mol电子,又根据阴极反应LaNi5+6e-+6H2O═LaNi5H6+6OH-,所以1mol镧镍合金转移6mol电子,所以2000mAh的1节镍氢电池则要镧镍合金的质量为$\frac{2000×3600}{96500}$×10-3mol×$\frac{1}{6}$×(139+59×5+6)g/mol=5.4g,故C正确;
D、二次电池放电后可以充电重新使用,使活性物质获得再生,但实际上充放电次数仍有限制,故D正确;
故选A.
点评 本题考查原电池、电解池原理的理解和应用,主要是应用题干信息和知识迁移应用能力等问题的考查,书写电极反应是关键.


科目:高中化学 来源: 题型:选择题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 此反应为放热反应 | |
| B. | 此反应只有达到平衡时,密闭容器中的压强才不会变化 | |
| C. | 此反应达到1 000℃时的反应速率比700℃时大 | |
| D. | 该反应的化学平衡常数越大,反应物的转化率越低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | 结合质子(H+)的能力由强到弱的顺序是AlO${\;}_{2}^{-}$>OH->CO${\;}_{3}^{2-}$ | |
| D. | 反应Ⅰ、Ⅱ均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与Fe2O3发生铝热反应后固体物质增重 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl═2AlCl3+3H2↑可知:2Fe+6HCl═2FeCl3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Clˉ、CO32- | B. | Mg2+、NO3-、SO42- | ||
| C. | K+、Clˉ、HCO3- | D. | Na+、[Al(OH)4]ˉ、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
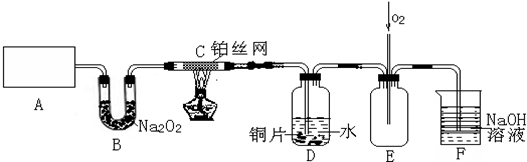
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com