
如下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
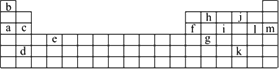
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力
②形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
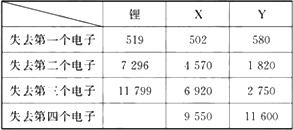
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量?________.
(2)表中X可能为以上13种元素中的________(填写字母)元素.用元素符号表示X和j形成化合物的化学式________.
(3)Y是周期表中________族元素.
(4)以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多.
(5)用电子式表示c和l形成化合物的过程________.
|
答案: 解析:(1)锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的1个电子后,锂离子处于稳定结构,根据题给信息2可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量. (2)由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的2倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层.结合所给的周期表知,X应为a即钠元素,和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2. (3)由表中所给Y的数据可知,Y失去第一、二、三个电子所需能量差别不大,而失去第四个电子所需能量远大于失去第三个电子所需的能量,因此Y元素的最外层有3个电子即为第ⅢA族的元素. (4)从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关.结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多. (5)c是Mg,l是Cl,两者形成离子化合物MgCl2. |


科目:高中化学 来源: 题型:阅读理解
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
| M | ||
4
|
| M | ||
4
|
查看答案和解析>>
科目:高中化学 来源: 题型:









查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 下表是元素周期表的一部分.表中所列的编号分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的编号分别代表一种化学元素.| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ||||||||||||||
| ⑩ | ⑧ | ⑨ | |||||||||||||||
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i | |
| 4 | j |
k | l |
| 电离能kJ/mol | I1 | I2 | I3 | I4 |
| d | 738 | 1450 | 7730 | 10550 |
| e | 577 | 1817 | 2745 | 11578 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com