
分析 根据元素周期律的递变规律判断,元素周期表中,同一周期元素从左到右元素的原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱,以此解答该题.
解答 解:(1)同一周期元素从左到右元素的原子半径逐渐减小,同主族元素从上到下元素的原子半径逐渐增大,可知原子半径最大的是Na,最小的为H,
故答案为:Na;H;
(2)同一周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,且元素的非金属性越强,对应的单质的氧化性越强,元素的金属性越强,对应的单质的还原性越强,可知单质的还原性最强的为Na;单质的氧化性最强的元素是F,
故答案为:Na;F.
点评 本题考查元素周期表和元素周期律知识,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
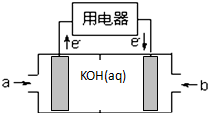 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
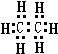 ,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.
,分子式为CmH20的烷烃中m为9,与CO2密度(同温同压)相同的烷烃分子式为C3H8,若上述三种烃各为1mol,在足量O2中燃烧,消耗O2最多的是C9H20.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(4) | B. | (2)(4) | C. | (4) | D. | (3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑥⑦⑧⑨ | C. | ④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


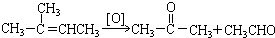
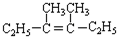 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、 -3 | +7、 -1 | +5、 -3 | -2 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com