
| A. | 90% | B. | 80% | C. | 70% | D. | 60% |
分析 令甲烷的物质的量为1mol,设分解的甲烷为xmol,根据方程式计算反应后混合气体的总的物质的量,根据质量守恒可知,反应后混合气体的质量等于起始甲烷的质量,根据m=nM计算出甲烷分解的物质的量,再求出分解率.
解答 解:令甲烷的物质的量为1mol,设分解的甲烷为xmol,则:
2CH4→C2H2+3H2 气体物质的量增大
2 2
xmol xmol
故反应后气体的总的物质的量为1mol+xmol,
故反应后混合气体的平均摩尔质量=$\frac{1mol×16g/mol}{(1+x)mol}$=10g/mol,
则x=0.6
则甲烷的分解率为$\frac{0.6mol}{1mol}$×100%=60%,
故选D.
点评 本题考查混合物的有关计算,难度不大,根据方程式计算反应后混合气体的总的物质的量是关键,注意把握公式的应用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
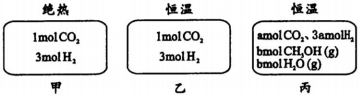
| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
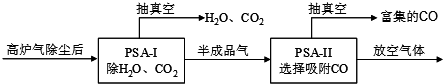
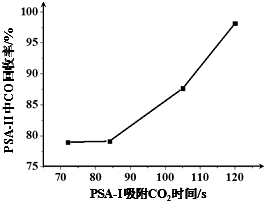
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )
)与甲酸、乙酸、丙酸在一定条件下发生酯化反应,可得到的甘油三酯最多有(不考虑立体异构)( )| A. | 16种 | B. | 17种 | C. | 18种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
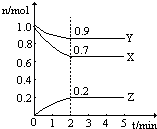 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com