
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A. B.
B.
(4)为加快反应速率,可以采取的措施__________。
a.降低温度;b.增大压强;c.恒容时充入He气;d.恒压时充入He气;e.及时分离出NH3
(5)下列可判断反应已达到平衡状态的是__________。
A 气体的平均摩尔质量不变
B N2、H2的反应速率比为1:3
C 混合气体的密度不变
D 生成1mol N2的同时生成2mol NH3
E N2、H2、NH3物质的量之比等于系数比
F 混合气体的总压强不再发生改变
【答案】1.2×10-3 mol·L-1·s-1 30% 46 A b ADF
【解析】
(1)图表中0~50s内氨气的浓度变化为0.24mol,可以计算氨气的反应速率,再根据速率之比等于化学方程式计量数之比计算氮气的反应速率;
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,由此计算氢气的转化率;
(3)反应焓变△H=反应物总键能-生成物总键能;依据焓变判断反应图像的变化;
(4)升高温度、增大压强、增大浓度、加入催化剂、增加接触面积等措施都可以加快反应速率;
(5)根据化学平衡的定义判断反应是否达到平衡状态。
(1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率v(NH3)= =0.0024mol/(Ls),v(NH3)∶v(N2)=2∶1,v(N2)=
=0.0024mol/(Ls),v(NH3)∶v(N2)=2∶1,v(N2)=![]() =1.2×10-3mol/(Ls),故答案为:1.2×10-3mol/(Ls);
=1.2×10-3mol/(Ls),故答案为:1.2×10-3mol/(Ls);
(2)250s时,生成氨气的物质的量为0.40mol,则反应的氢气的物质的量为0.6mol,转化率=![]() ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,N2(g)+3H2(g)2NH3(g),生成1molNH3反应过程中能量变化=![]() ×946kJ/moL+
×946kJ/moL+![]() ×436kJ/mol-3×391kJ/mol=-46kJ/mol,则生成1molNH3过程中的热量变化位46kJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,故答案为:46;A;
×436kJ/mol-3×391kJ/mol=-46kJ/mol,则生成1molNH3过程中的热量变化位46kJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,故答案为:46;A;
(4)a.降低温度,反应速率减小,故a错误;b.增大压强,反应速率增大,故b正确;c.恒容时充入He气,总压增大,分压不变,反应速率不变,故c错误;d.恒压时充入He气,体积增大,压强减小,反应速率减小,故d错误;e.及时分离NH3,氨气的浓度减小,反应速率减小,故e错误;故答案为:b;
(5)A.反应前后气体质量不变,气体物质的量减小,根M=![]() 可知,平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,说明达到平衡状态,故A选;B.根据方程式,N2、H2的反应速率比始终为1:3,N2、H2的反应速率比为1:3不能说明达到平衡状态,故B不选;C.反应前后气体质量不变、体积不变,根据ρ=
可知,平均相对分子质量是变量,混合气体的平均相对分子质量保持不变,说明达到平衡状态,故A选;B.根据方程式,N2、H2的反应速率比始终为1:3,N2、H2的反应速率比为1:3不能说明达到平衡状态,故B不选;C.反应前后气体质量不变、体积不变,根据ρ=![]() 可知,密度是恒量,混合气体的密度保持不变,不一定达到平衡状态,故C不选;D.生成1mol N2的同时一定分解2mol NH3,因此生成1mol N2的同时生成2mol NH3,说明正逆反应速率相等,达到平衡状态,故D选;E. N2、H2、NH3物质的量之比等于系数比,不能说明三者的物质的量不变,不能说明达到平衡状态,故E不选;F. 反应前后气体物质的量是变量,即反应过程中混合气体的总压强为变量,总压强不再发生改变,说明达到平衡状态,故F选;故答案为:ADF。
可知,密度是恒量,混合气体的密度保持不变,不一定达到平衡状态,故C不选;D.生成1mol N2的同时一定分解2mol NH3,因此生成1mol N2的同时生成2mol NH3,说明正逆反应速率相等,达到平衡状态,故D选;E. N2、H2、NH3物质的量之比等于系数比,不能说明三者的物质的量不变,不能说明达到平衡状态,故E不选;F. 反应前后气体物质的量是变量,即反应过程中混合气体的总压强为变量,总压强不再发生改变,说明达到平衡状态,故F选;故答案为:ADF。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是
A. 1mol![]() 与4mol
与4mol![]() 反应生成的
反应生成的![]() 分子数为
分子数为![]()
B. 1molFe溶于过量硝酸,电子转移数为![]()
C. 14g乙烯和丙烯混合气体中的氢原子数为![]()
D. 标准状况下,2.24L![]() 含有的共价键数为0.4
含有的共价键数为0.4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
B. CH3CH2CH2CH2CH3和 ![]() 互为同素异形体
互为同素异形体
C. CH3CH2OH和 ![]() 具有相同的官能团,互为同系物
具有相同的官能团,互为同系物
D.  和
和 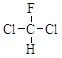 为同一物质
为同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解精炼铜时,粗铜跟电源的正极相连
B.用石墨做电极电解饱和食盐水时,阴极产生黄绿色气体
C.构成原电池的正极和负极必须是两种不同金属
D.原电池是把化学能转变为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
A. 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,CH3COO-数目是NA
B. 1.68gFe与足量高温水蒸气反应,转移电子的数目为0.09NA
C. 氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA
D. 常温下,2L 0.1molL-1FeCl3溶液与1L0.2molL-1FeCl3溶液所含Fe3+数目不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D的单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)写出AB2的电子式:______________;
(2)用电子式表示C2B的形成过程:__________________________________。
(3)写出淡黄色固态化合物与水反应的化学方程式:_______________________________。
(4)请设计简单实验,比较元素B、D的金属性(或非金属性)强弱:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是
A.原来盐酸的物质的量浓度等于氨水的物质的量浓度
B.所得溶液中c(NH4+)=c(Cl—)
C.所得溶液中c(NH4+)+c(H+)=c(Cl—)
D.所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com