
【题目】在恒容的密闭容器中充入适量NO2,发生如下反应:2NO2(g) ![]() N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
N2O4(g),当分离出部分N2O4时,下列说法中正确的是( )
A. υ(正)增大B. 平衡逆向移动C. υ(正)>υ(逆)D. NO2转化率不变
【答案】C
【解析】
恒容的密闭容器中充入适量NO2,发生反应2NO2(g)N2O4(g),当分离出部分N2O4时,瞬间NO2的浓度不变,N2O4的浓度减小,平衡正向移动,υ(正)>υ(逆),正反应速率在减小,直到正逆反应速率相等,以此来解答。
A.分离出部分N2O4时,瞬间NO2的浓度不变,N2O4的浓度减小,平衡正向移动,υ(正)>υ(逆),正反应速率在减小,直到正逆反应速率相等,故A错误;
B.减小生成物的浓度,平衡正向移动,故B错误;
C.由A可知,减小生成物浓度,平衡正向移动,υ(正)>υ(逆),故C正确;
D.因平衡向正反应方向移动,则NO2转化率增大,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2═4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的是( )
A.4/5v(O2)= v(NO)
B.5/6v(O2)= v(H2O)
C.2/3v(NH3)= v(H2O)
D.4/5v(NH3)= v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
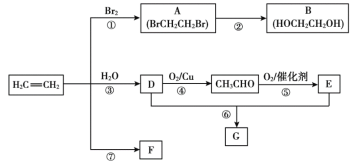
已知:2CH3CHO+O2催化剂,加热2CH3COOH
(1)反应①的反应类型为___,B的官能团是___(填名称)。
(2)反应③的化学方程式是___。
(3)F是一种高分子化合物,可用于制作食品袋,其结构简式为___。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。
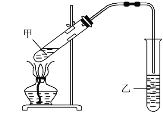
i.反应⑥的化学方程式是____。
ii.实验采用酒精灯加热的目的是___,乙中的试剂为___。
制法二:工业上用CH2=CH2和E直接反应获得G。
iii.该反应的的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某饱和溶液的:①溶剂的质量;②溶液的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度。下列组合不能计算出该溶液的物质的量浓度的是
A. ①②④⑥ B. ④⑤⑥ C. ②③④⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可通过蒸馏石油得到多种沸点范围不同的馏分,装置如图所示。下列说法不正确的是
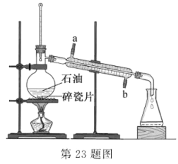
A.沸点较低的汽油比沸点较高的柴油先馏出
B.蒸馏烧瓶中放人沸石可防止蒸馏时发生暴沸
C.冷凝管中的冷凝水应该从 a 口进 b 口出
D.温度计水银球的上限和蒸馏烧瓶支管口下沿相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),下列说法不正确的是( )
Ag+(aq)+Cl-(aq),下列说法不正确的是( )
A. 除去溶液中Ag+加盐酸盐比硫酸盐好
B. 加入H2O,溶解平衡不移动
C. 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
D. 反应2AgCl+Na2S![]() Ag2S+2NaCl说明溶解度:AgCl>Ag2S
Ag2S+2NaCl说明溶解度:AgCl>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,CH4与O2的密度之比1:2
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,在标准状况下的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:K+、Fe2+、MnO![]() 、SO
、SO![]()
B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
C.c(H+)/c(OH-)=1012的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D.与铝反应生成氢气的溶液中:NH![]() 、K+、Cl-、SiO
、K+、Cl-、SiO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,可用于合成抗生素头孢菌素药物的中间体、汽车安全气囊的药剂等。氨基钠(NaNH2)的熔点为210℃,沸点为400℃,在水溶液中易水解。实验室制取叠氮化钠的实验步骤及实验装置如下:
①打开止水夹K1,关闭止水夹K2,加热装置D一段时间;
②加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭K1;
③向装置A中b容器内加入加热介质并加热到210~220℃,打开止水夹K2,通入N2O;
④冷却,向产物中加入乙醇,减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
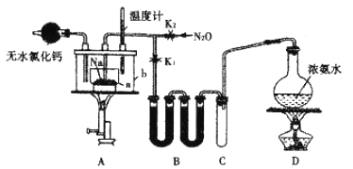
回答下列问题:
(1)装置B中盛放的药品为____________。
(2)氨气与熔化的钠反应生成NaNH2的化学方程式为__________。
(3)步骤③中,为了使反应受热均匀,A装置里a容器的加热方式为__________;生成NaN3的化学方程式为__________;N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则应选择的气体发生装置是_____________(填序号)。

(4)步骤④中用乙醚洗涤的主要目的是______________。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol/L(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+,则试样中NaN3的质量分数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com