
| A. | 两种气体的物质的量之比为3:2 | B. | 两种容器的体积之比为2:3 | ||
| C. | 两种气体的分子数相等 | D. | 两种气体的密度之比是3:2 |
分析 A.根据n=$\frac{m}{M}$计算判断;
B.两种容器的体积之比为气体体积之比,同温同压下,气体的体积之比等于其物质的量之比;
C.气体分子数目之比等于其物质的量之比;
D.同温同压下,气体密度之比等于其摩尔质量之比.
解答 解:A.根据n=$\frac{m}{M}$可知,等质量的O2、O3气体的物质的量之比为48g/mol:32g/mol=3:2,故A正确;
B.两种容器的体积之比为气体体积之比,同温同压下,气体的体积之比等于其物质的量之比,故两种容器的体积之比为3:2,故B错误;
C.等质量的O2、O3气体分子数目之比为3:2,故C错误;
D.同温同压下,气体密度之比等于其摩尔质量之比,等质量的O2、O3气体的密度之比为32g/mol:48g/mol=2:3,故D错误,
故选:A.
点评 本题考查物质的量计算、阿伏伽德罗定律及其推论,难度不大,注意根据PV=nRT理解阿伏伽德罗定律及其推论.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
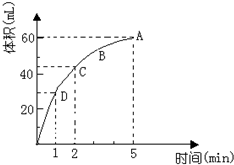 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com