
【题目】某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是
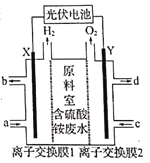
A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
【答案】D
【解析】
A、观察装置图可知,处理废水实质上是电解水。X极上产生H2,发生了还原反应,X极为阴极,Y极为阳极,Y极上发生氧化反应。X极的电极反应式为2H2O+2e-= =2OH- +H2↑,硫酸铵电离出的铵根离子向X极迁移,NH4++OH-=NH3H2O,离子交换膜1为阳离子交换膜,选项A正确;
B、a口进入稀氨水,氨水增强水的导电性,Y极产生O2,离子交换膜2为阴离子交换膜,SO42-经过离子交换膜2向Y极迁移,所以c口进入稀硫酸增强导电性,d口流出较浓硫酸,选项B正确;
C、Y极产生O2,在稀硫酸中水参与电极反应,选项C正确;
D、由电极反应式知,转移0.2 mol电子时可生成0.1 mol H2SO4,即生成9.8g H2SO4,选项D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.升高温度B.加入适量的水
C.加入少量CuSO4溶液D.加入浓度较大的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1、3、5号试管中分别加入2 mL蒸馏水,2、4、6号试管中分别加入2 mL发芽的小麦种子匀浆样液,然后在1~4号试管中适量滴加斐林试剂,5、6号试管中合理滴加双缩脲试剂,摇匀。预期观察到的实验现象是

A. 1、3、5号试管内都呈蓝色
B. 3组实验中甲组和乙组的实验结果相同
C. 4号试管内呈砖红色,其余试管内都呈蓝色
D. 4号试管内呈砖红色,5号试管内呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4 还原为 Na2S。下列说法不正确的是

A. 充电时,太阳能转化为电能,电能又转化为化学能
B. 放电时,a 极为负极
C. M 是阴离子交换膜
D. 充电时,阳极的电极反应式为 3I--2e-= I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:C(s)+CO2(g)=2CO(g),下列说法不正确的是( )
A. 将碳块磨成粉末可以加快反应速率
B. 升高温度可以加快反应速率
C. 增加碳的质量可以加快反应速率
D. 容器体积不变时,向其中充入N2,反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:

(1)操作④中所需的玻璃仪器有__________________。
(2)操作②为什么不用硝酸钡溶液,其理由是__________。
(3)进行操作②后,如何判断SO42-已除尽,方法是______
(4)操作③的目的是__________,其相应的化学方程式为:_____;为什么不先过滤,后加碳酸钠溶液,其理由是_______。
(5)说明此设计方案不严密之处及正确的方法____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A. 化学反应速率关系是:2v正(NH3) = 3v正(H2O)
B. .若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2) = 5v逆(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com