
 250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
250 mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液。用0.1010 mol·L-1的NaOH标准溶液滴定至终点。按上述操作方法再重复2次。 | 滴定次数 | 待测溶液体积/ml | 标准NaOH溶液体积读数(ml) | |
| 滴定前/ml | 滴定后/ml | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.30 | 22.30 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸。 | |
| 步骤3:取适量步骤1中的沉淀于试管中,________。 | |
| 步骤4: | |
 _,将溶液转入________中,洗涤,定容,摇匀。
_,将溶液转入________中,洗涤,定容,摇匀。 填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。
填“能”或“不能”)配制1.0 mol·L-1 Ba(OH)2溶液。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ______(填“偏高”、“不变”或“偏低”)。
______(填“偏高”、“不变”或“偏低”)。| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。 | 若不出现浑浊,则溶液中不存在SO32-, 若出现浑浊,则溶液中可能含有SO32-。 |
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入 。 | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 器.
器.查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向NaAlO2溶液中滴加饱和NaHCO3溶液,有白色沉淀产生 | 验证两者都发生了水解反应,且相互促进 |
| B | 苯酚溶液中加入几滴稀溴水没有白色沉淀出现 | 说明苯酚与溴没有发生反应 |
| C | 常温下白磷可自燃而氮气需要在放电时才与氧气反应 | 非金属性:P>N |
| D | 向相同体积、相同pH的两种一元酸中分别加入足量锌粉,测量产生氢气的体积 | 可以比较两种一元酸的酸性相对强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.皮肤上沾有少量苯酚,立即用大量浓氢氧化钠溶液洗去 |
| B.欲提纯鸡蛋白溶液中的蛋白质,用饱和的醋酸铅溶液进行盐析 |
| C.金属钠非常活泼,应将其保存在汽油中,以隔绝空气和水 |
D.仅 用溴水可鉴别苯、四氯化碳、2-戊烯、乙醇四种无色液体 用溴水可鉴别苯、四氯化碳、2-戊烯、乙醇四种无色液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
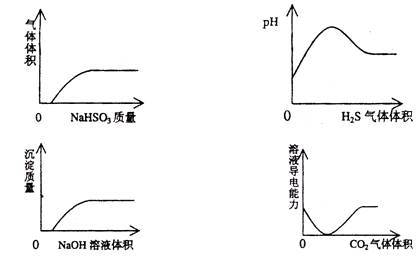
| A.NaHSO3粉末加入HNO3溶液中 |
| B.H2S气体通入氯水中 |
| C.NaOH溶液滴入Ba(HCO3)2溶液中 |
| D.CO2气体通入澄清石灰水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com