
 莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有三种含氧官能团 | |
| B. | 可发生取代、加成及氧化反应 | |
| C. | 在水溶液中羟基和羧基均能电离出氢离子 | |
| D. | 与足量的钠反应在标况下能产生44.8L气体 |
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| B. | 常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(SO42-) | |
| C. | AgCl的Ksp=1.8×10-10 mol2•L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2•L-2 | |
| D. | 将10 mL 0.1 mol/L Na2SO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:c(Na+)>c(Cl-)>c(HSO3-)>c(SO32-) |
查看答案和解析>>
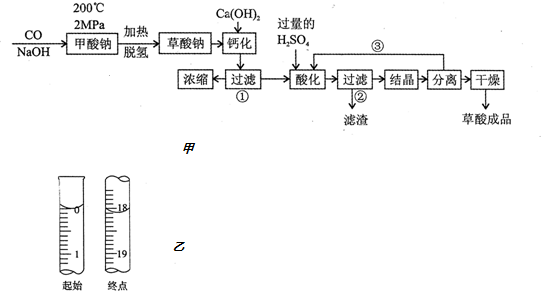
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
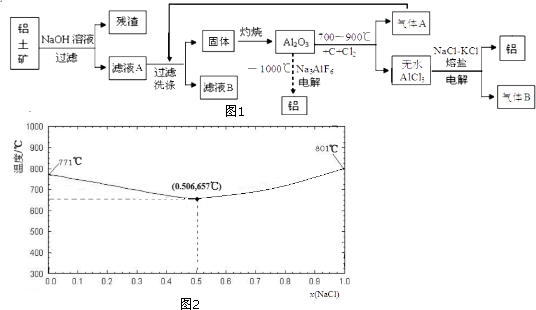
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化合物A的分子式为C15H21O3 | |
| B. | 化合物A是芳香族化合物 | |
| C. | 化合物A可以发生取代反应、加成反应、酯化反应和银镜反应 | |
| D. | 1mol化合物A最多可与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
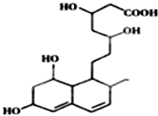
| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com