
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al → Al2O3 → Al(OH)3 → NaAlO2
B. Si → SiO2 → H2SiO3 →Na2SiO3
C. N2 → NO → NO2 → HNO3
D. S → SO3 → H2SO4 → MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是
A.Na2CO3和Na2O2都属于盐 B.KOH和KHCO3都属于碱
C.H2SO4和H3PO4都属于酸 D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.20molL﹣1的H2SO4溶液中,H+的物质的量浓度为( )
A. 0.10 molL﹣1 B. 0.20 molL﹣1 C. 0.40 molL﹣1 D. 0.50 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现钼酸钠可减缓金属的腐蚀速率。工业上利用钼精矿(主要成分是不溶于水的MoS2,含少量重金属化合物)制备钼酸钠晶体( Na2MoO4·2H2O)的途径如图所示:
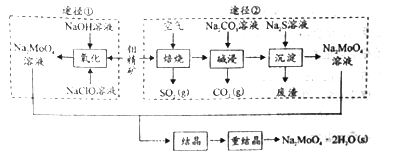
回答下列问题:
Ⅰ.(1)下列标志中,应贴在保存NaClO容器上的是____________。

(2)为了提高焙烧效率,除增大空气量外还可以采用的措施有__________________。
(3)途径①制备钼酸钠溶液,同时有SO42-生成,该反应的离子方程式为_____________。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是________________________。
(5)“结晶”前测得部分离子浓度c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L,需加入Ba(OH)2固体除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为______%。(保留三位有效数字)。
Ⅱ.(1)碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
(2)若缓释剂钼酸钠-月桂酰肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为_________(保留三位有效数字)。[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入 Ba(OH)2固体引起溶液体积变化可忽略]。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。

下列说法不正确的是
A.若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B.若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C.若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D.若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①新制氯水经光照一段时间pH减小
②Al和Fe都可以利用致密的氧化膜保护内层金属不被腐蚀
③Al2O3和Fe2O3都为碱性氧化物,所以都能溶于硫酸
④pH在5.6~7.0之间的降水通常称为酸雨
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一。下列说法正确的是( )
A. 乙烯可与乙醇发生酯化反应
B. 乙烯可使酸性KMnO4溶液褪色
C. 一定条件下乙烯可发生聚合反应
D. 一定条件下乙烯可发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com