
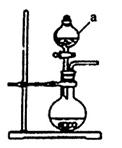
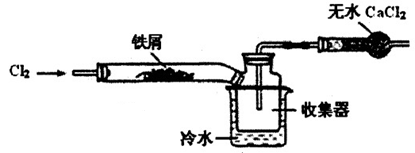
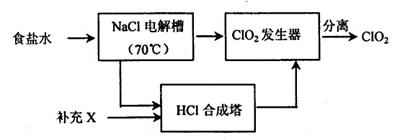
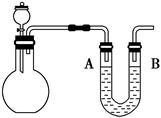
| A.体系冷却后,停止通入Cl2 |
| B.通入干燥的Cl2赶尽装置中的空气 |
| C.在铁屑下方加热至反应完成 |
| D.用干燥的H2赶尽Cl2 |
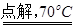 NaClO3+3H2
NaClO3+3H2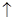 ,
, +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。| 物质 | 熔点/℃ | 沸点/℃ |
| C1O2 | -59 | 11 |
| Cl2 | -107 | -34.6 |
 CO32?+H+,K2=[CO32?][H+]/[HCO3?]=5.6×10-11, 可得[CO32-]:[HCO3-]= K2/[H+]=5.6×10-11/10-8=5.6×10-3
CO32?+H+,K2=[CO32?][H+]/[HCO3?]=5.6×10-11, 可得[CO32-]:[HCO3-]= K2/[H+]=5.6×10-11/10-8=5.6×10-3

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
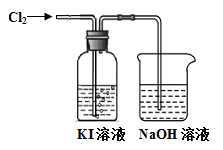
 I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。
I3- ,I2、I3-在水中均呈黄色。为确定黄色溶液的成分,进行了以下实验。| | 操作 | 实验现象 |
| a | 取2~3 mL黄色溶液,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色, 水层显浅黄色。 |
| b | 取2~3 mL饱和碘水,加入足量CCl4, 振荡静置。 | CCl4层呈紫红色,水层几近无色。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体 |
B.浓硫酸与单质硫反应的化学方程式为:S+2H2SO4(浓)  3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性 3SO2↑+2H2O,在此反应中,浓硫酸既表现了其强氧化性又表现了其酸性 |
| C.把足量铜粉投入到只含H2SO4 2 mol的浓硫酸中,得到气体体积标准状况下为22.4 L |
| D.常温下能够用铁、铝等容器盛放浓H2SO4,是因为浓H2SO4的强氧化性使其钝化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
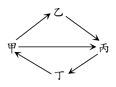
| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | S | SO2 | H2SO4 | SO3 |
| B | CO2 | Na2CO3 | NaHCO3 | CaCO3 |
| C | N2 | HNO3 | NO2 | NH3 |
| D | SiO2 | Na2SiO3 | H2SiO3 | CaSiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
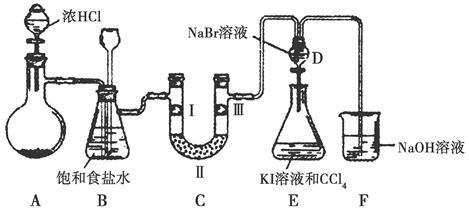
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
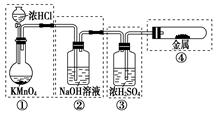
| A.①② | B.② | C.②③ | D.②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com