
分析 该镁铝碱式碳酸盐(镁铝碱式酸盐Mg6Al2(OH)16CO3•4H2O)可以由MgCl2、NaAlO2、NaOH和Na2CO3反应制备,结合原子守恒配平书写化学方程式.
解答 解:镁铝碱式碳酸盐可以由MgCl2、NaAlO2、NaOH和Na2CO3反应制备,反应的化学方程式为6MgCl2+2NaAlO2+8NaOH+Na2CO3+8H2O=Mg6Al2(OH)16CO3•4H2O↓+12NaCl,
故答案为:6MgCl2+2NaAlO2+8NaOH+Na2CO3+8H2O=Mg6Al2(OH)16CO3•4H2O↓+12NaCl.
点评 本题考查方程式的书写,根据镁铝碱式碳酸盐以及反应物结合原子守恒即可书写,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 |
| 实验步骤 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于空气中,观察现象 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于氧气中,观察现象 | 取少量淀粉碘化钾溶液置于试管中,通往足量的氯气,观察现象 |
| 实验现象 | 试纸缓慢变蓝 | 试纸不变蓝 | 溶液先变蓝后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:4:7 | B. | 4:2:7 | C. | 7:4:2 | D. | 3:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
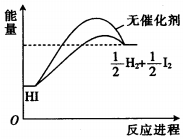
| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com