
(1)(4分)良好的生态环境可以提升生活质量。
①空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是 ▲ (选填字母,下同)。 a.SO2 b.NO2 c.CO2 d.PM2.5 e.氯氟烃
②垃圾应分类收集。以下物质应放置于贴有“  ”标志垃圾筒的是 ▲ 。
”标志垃圾筒的是 ▲ 。
a.废电池 b.废铝制的易拉罐 c.建筑固弃物、渣土
③近日,公安机关成功破获了一起特大利用“地沟油”制售食用油案件。综合利用“地沟油”的一种方法,通常将“地沟油”进行简单加工提纯后,水解分离可获取 ▲ 和 ▲ (填名称)。
(2)(7分)人体健康与食品、药物等关系密切。
①合理搭配饮食是我们的健康理念。比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、糖类、 ▲ 、 ▲ 、无机盐和水。
②生活中应合理地摄取人体必需的元素,体内 ▲ 元素含量过高或过低,会引起甲状腺疾病;当人体内缺钙时,可能患有的疾病是 ▲ 。a.贫血 b.骨质疏松 c.夜盲症
③ 氢氧化铝可以用来治疗胃酸过多,请写出该反应的离子方程式 ▲ 。
④青霉素适合治疗的疾病是 ▲ 。a.感冒发烧 b.细菌感染 c.胃酸过多
(3)(4分)材料是人类赖以生存和发展的重要物质基础。
①在下列材料中,属于有机高分子材料的是 ▲ ;属于复合材料的是 ▲ 。
a.硬币 b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②硅酸盐水泥是常用的建筑材料,它主要是以 ▲ 和黏土为原料制成。
③钢铁在潮湿的空气中主要发生的电化学腐蚀是 ▲ 腐蚀,通常用钝化、涂漆、电镀等方法来防止腐蚀。
科目:高中化学 来源: 题型:
能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g) CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
①该电池负极的电极反应为 。
②工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质 ,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
A.CuO B.CuCO3 C.Cu(OH)2 D.Cu2(OH)2CO3

查看答案和解析>>
科目:高中化学 来源: 题型:
将Mg、Cu组成的混合物26.4 g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是:( )
A.32.8g B.46.8g C.53.6g D.63.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
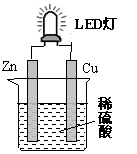
右图是课外活动小组设计的用化学电源使LED灯
发光的装置。下列说法错误的是
A.铜片表面有气泡生成
B.装置中存在“化学能→ 电能→ 光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A.甲装置:可用来证明硫的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法能检查此装置的气密性
D.丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A.NO2由反应N2+2O2 2NO2生成
2NO2生成
B.总反应可表示为2SO2+O2+2H2O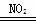 2H2SO4
2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O=4HNO3
D.还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
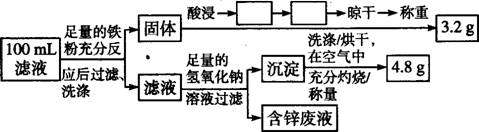
在上述流程中空格内填上相应的操作: 、 ;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )

|
| A. | 升高温度,平衡常数减小 |
|
| B. | Z在a、c两点的反应速率相等 |
|
| C. | b点时,Z的转化率最小 |
|
| D. | 平衡时充入惰性气体时,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com