
科目:高中化学 来源: 题型:
| A、KCl中含有35Cl |
| B、生成物Cl2的相对分子质量为73.3 |
| C、该反应转移的电子数为6e- |
| D、氧化剂和还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-
(1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-| 放电 |
| 充电 |
| 电池 | 电解池 | |
| A | H+移向pb电极 | H+移向pb电极 |
| B | 每消耗3mol pb | 生成2molAl2O3 |
| C | 正极:pbO2+4H++2e-=pb2++2H2O | 阳极:2AL+3H2O-6e-═AL2O3+6H+ |
| D |  | 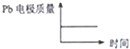 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验事实 | 结论或解释 | |
| A. | 将40 g NaOH溶于1 L蒸馏水中. | 该 溶液中溶质的质量分数为3.84%,其物质的量浓度为1mol?L-1 |
| B. | 向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体. | 还原性Al<Cu |
| C. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| D. | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com