
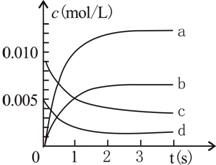
 800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:
800℃时,在2L密闭容器内加入N0和02,发生反应:2N0(g)+O2(g)?2N02(g),测得n(N0)随时间的变化如表,请回答:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
分析 (1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO);
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)由表中数据可知从3s开始,NO的物质的量为0.007mol,不再变化,3s时反应达平衡,所以平衡时NO的浓度为$\frac{0.007mol}{2L}$=3.5×10-3mol•L-1,故答案为:3.5×10-3mol•L-1;
(2)NO2是产物,随反应进行浓度增大,由方程式可知平衡时△c(NO2)=△c(NO)=$\frac{(0.02-0.007)mol}{2L}$=0.0065mol/L,所以图中表示NO2变化的曲线是b,
故答案为:b;
(3)a.随反应进行,反应混合气体总的物质的量在减小,气体总物质的量保持不变,说明反应到达平衡,故a正确;
b.可逆反应是动态平衡,到达平衡正逆速率相等,但不为0,故b错误;
c.平衡时各组分浓度关系与起始浓度及转化率有关,不一定等于化学计量数之比,故c错误;
d.容器内NO气体的体积分数不变,说明反应到达平衡,故d正确.
故选:ad.
点评 本题考查化学平衡计算、化学平衡状态的判断、外界条件对化学平衡移动的影响的知识,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部都是副族元素 | |
| B. | 短周期共有32 种元素 | |
| C. | 科学研究时,经常在过渡元素中寻找耐高温、耐腐蚀的合金材料 | |
| D. | 元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
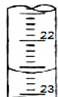 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
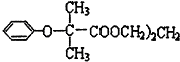 )可用于降低血液中的胆固醇,该物质合成线路如图所示:
)可用于降低血液中的胆固醇,该物质合成线路如图所示: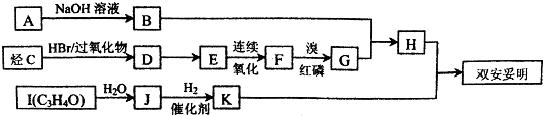
 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$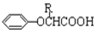
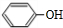 ,J中所含官能团名称为醛基、羟基.
,J中所含官能团名称为醛基、羟基.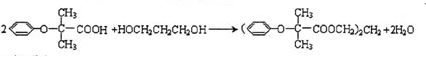 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的烯烃 | B. | 分子式为C4H8O2的酯 | ||
| C. | 甲苯(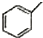 )的一氯代物 )的一氯代物 | D. | 立体烷( 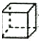 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4H++4Cl-=Mn2++2Cl2↑+2H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com