
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
【答案】C
【解析】加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在SO42–、CO32–,硫酸钡沉淀是2.33g,物质的量是2.33g÷233g/mol=0.01mol,碳酸根离子的物质的量是(4.32.33)g÷197g/mol=0.01mol,硫酸根、碳酸根和钙离子不共存,一定不存在Ca2+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,根据元素守恒,铵根离子的物质的量是0.672L÷22.4L/mol=0.03mol,钾离子和氯离子需要根据电荷守恒进行判断,以此解答该题。
A.由以上分析可知原溶液一定存在SO42–、CO32–和NH4+,A正确;
B.根据以上分析可知原溶液中一定不存在Ca2+,无法判断Cl–是否存在,B正确;
C.由于前面加入了氯化钡溶液,因此取少许溶液2加入硝酸银和稀硝酸无法检验原溶液中是否含有氯离子,C错误;
D.阳离子所带正电荷的物质的量之和0.03mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,由电荷守恒可知一定含有钾离子,如钾离子的物质的量大于0.04mol-0.03mol=0.01mol(阴离子和阳离子电荷之差),则含有氯离子,则原溶液中 c(K+)≥0.01mol÷0.1L=0.1 mol· Lˉ1,D正确。答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性,下列有关说法正确的是
A. H3PO2溶于水的电离方程式为:H3PO2 ![]() 3H++PO23-
3H++PO23-
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O=O2+6H++PO23-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式:6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g) ![]() C H4 (g)+2 H2O(g);向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1, H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
C H4 (g)+2 H2O(g);向一容积为 2 L的恒容密闭容器中充人一定量的CO2和H2,在 300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1, H2 0.8 mol·L一1,CH40.8 mol·L一1,H2O1.6 mol·L一1。则300℃时上述反应的平衡常数K=____________________。 200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)0。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
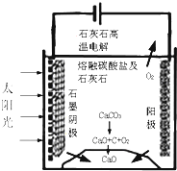
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能 b、太阳能转化为电能
c、太阳能转化为化学能 d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。


![]()



(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
p>①所用指示剂为__________;滴定终点时的现象为_____________________________________;②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素.它们的结构、性质等信息如下表所述:

请根据表中信息填写:
(1)A原子的核外电子排布式为________________。
(2)B元素在周期表中的位置是____;离子半径:B_____A(填“大于”或“小于”)。
(3)C原子的电子排布图是________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
(4)D原子的外围电子排布式为____________,D-的结构示意图是____________。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为________;B的最高价氧化物对应的水化物与D的氢化物的水溶液反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3会快速分解为FeBr2。某化学小组同学用下图所示装置制备溴化亚铁,请回答相关问题:
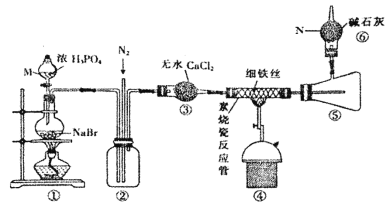
(1)仪器M、N的名称依次是________、________。
(2)装置⑥的作用是____________,从装置末端排出的气体是否需要处理________(填“是”或“否”)
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是__________。
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具备某种性质,该性质是________。
②溶液变橙黄色是因为发生了副反应___________(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度_____ (填“有”或“没有”)影响,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )

A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH=_________________________。
CO2(g)+4H2(g) ΔH=_________________________。
(2)起始时投入氮气和氢气的物质的量分别为1 mol、3 mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是________(填序号)。
A N2和H2的转化率相等 B 反应体系密度保持不变
C c(H2)/c(NH3 )保持不变 D c(NH3 )/c(N2)=2
②p1________(填“>”、“<”、“=”或“不确定”,下同)p2;反应的平衡常数:B点________D点。
③C点H2的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)________v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式________________________________。
②已知25 ℃时,N2H4的水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH-K1=1×10-a N2H5++H2O
N2H5++OH-K1=1×10-a N2H5++H2O![]() N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填标号)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是___________________。
在分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com