
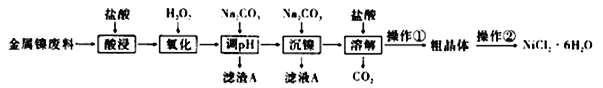
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl2·6H2O)流程如下:
下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Al(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入H2O2氧化时发生反应的离子方程式为______,调pH的范围为_______,若调pH=6,则溶液中c(Al3+):c(Fe3+)=________。(已知Ksp[Al(OH)3]=1×10-34,Ksp[Fe(OH)3]=1×10-38)
(2)滤液A的溶质主要是_______。
(3)操作①的实验方法依次是_________、冷却结晶、过滤、洗涤、干燥。
【答案】2Fe2++H2O2+2H+=2Fe3++2H2O 4.7≤pH<7.1 10000:1 NaCl和Na2CO3 蒸发浓缩
【解析】
利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl26H2O),由流程可知,加盐酸酸浸后的酸性溶液中主要含有Ni2+、Cl-,还含有少量Fe2+、Al3+,加入过氧化氢,氧化Fe2+为Fe3+,加入Na2CO3溶液调节溶液的pH,使Fe3+、Al3+全部沉淀,滤渣A为Fe(OH)3和Al(OH)3,再向滤液中加入Na2CO3溶液可以沉淀Ni2+得NiCO3,滤液A含NaCl和Na2CO3,将NiCO3再溶于盐酸,得NiCl2溶液,操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,操作②为重结晶,将得到的氯化镍晶体重新溶解,再进行结晶,从而得到NiCl26H2O,以此来解答。
(1) H2O2具有强的氧化性,加入H2O2氧化,可将溶液中的Fe2+转化为Fe3+,该反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;第一次加入Na2CO3溶液调pH的目的是将Fe3+和Al3+都转化为金属氢氧化物,形成Fe(OH)3和Al(OH)3沉淀除去,而Ni2+不能沉淀,结合表中数据可知pH的范围是4.7≤pH<7.1;当溶液的pH=6时,Fe(OH)3和Al(OH)3都沉淀完全,由于二者的化合物构型相同,所以溶液中c(Al3+):c(Fe3+)=Ksp[Al(OH)3]:Ksp[Fe(OH)3]=( 1×10-34):(1×10-38)=10000:1;
(2)第二次加Na2CO3沉镍,过滤,得到滤液A的溶质主要是NaCl和Na2CO3;
(3)操作①的实验方法是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1) 化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g) △H<0。不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”)。
②T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数K=_____________ (用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
(3)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示。写出总反应化学方程式:_____________。


②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如上图所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是__________。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如题图所示。若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为_____mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )

A. 铁片发生还原反应而被腐蚀
B. 铁片腐蚀最严重区域应该是生锈最多的区域
C. 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D. 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究二氧化硫的性质,按如图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________,反应的化学方程式为_______________。
(2)装置B中的现象是__________________,反应的离子方程式为_________________。
(3)装置C中的现象是____________________,该现象说明二氧化硫具有的性质是________________________。
(4)装置D的目的是探究二氧化硫与品红作用的可逆性,写出实验操作及现象_____________。
(5)尾气可采用__________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.在100 mL 1 molL1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++![]() +4H+
+4H+
B.在100 mL 2 molL1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2![]() +Ca2++2OH-═CaCO3↓+2H2O+
+Ca2++2OH-═CaCO3↓+2H2O+![]()
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2![]() +2Ba2++4OH-═2BaSO4↓+
+2Ba2++4OH-═2BaSO4↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.![]() 的名称为螺[5,4]壬烷
的名称为螺[5,4]壬烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com