
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
( )
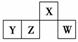
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.气态氢化物的热稳定性:Z>W
D.X与H、O元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
碘与氢气反应的热化学方程式如下:
①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是人们开发利用的一种新能源,已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
③CH3OH(l)===CH3OH(g) ΔH3=+37.4 kJ·mol-1
(1)写出表示甲醇燃烧热的热化学方程式:__________________________________________________________
__________________________________________________________。
(2)H2的燃烧热为__________________________________________________________。
(3)二甲醚也是一种新型燃料,1 mol二甲醚蒸气完全燃烧生成CO2和液态水时放出1 455 kJ热量,若1 mol二甲醚和甲醇的混合气体完全燃烧生成CO2和液态水时共放出1 224.9 kJ热量,则混合气体中甲醇和二甲醚的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组的同学用下列仪器组装两套完全相同的装置,定量探究浓度对反应速率的影响。
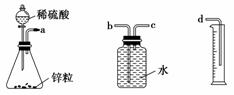
(1)为达到本实验的目的,其装置连接顺序为a连________,________连________。
(2)连接好装置后的下一步操作是__________________________________________________________。
(3)锥形瓶中发生反应的离子方程式为__________________________________________________________。
(4)两套装置的分液漏斗所装的试剂分别为1 mol·L-1硫酸和4 mol·L-1硫酸,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1 mol·L-1硫酸 | 10 mL | t1 | v1 |
| 4 mol·L-1硫酸 | 10 mL | t2 | v2 |
该小组同学通过实验得到的结果是:v1小于v2,其定量依据是________。
(5)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol·L-1) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请在给定的坐标图中作出v(H2)-t的图像。
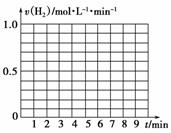
请解释0到4 min时该化学反应速率随时间变化的原因:__________________________________________________________
__________________________________________________________。
(6)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方法有:__________________________________________________________
__________________________________________________________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中有Fe3+、Mg2+、Fe2+和Na+四种离子,向其中加入过量的氢氧化钠溶液并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
|
| A. | Fe3+ | B. | Mg2+ | C. | Fe2+ | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
①用一种试剂将下列各组物质鉴别开.
(1) 和
和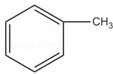 :
:
(2) ,
, 和C6H12(已烯):
和C6H12(已烯):
(3)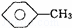 ,CCl4和乙醇
,CCl4和乙醇
②填写
(1)CH3COOC2H5中含有官能团的名称:
(2)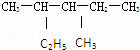 的系统命名:
的系统命名:
(3)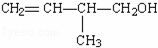 的键线式: .
的键线式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com