
某课外活动小组设计了如图所示的装置,调节滑动变阻器控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了很令人高兴的现象。(阳离子交换膜只允许阳离子和水通过)
请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:________;阳极:________。
(2)观察到A装置中的现象是:①________;②________;③________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置,若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):____________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见:
__________________________________________________________________。
科目:高中化学 来源: 题型:填空题
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计

此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是 。
(2)实验步骤②中应观察到的现象是 。
(3)实验步骤③中应观察到的现象是 。
(4)实验步骤④中应观察到的现象是 。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是 。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型锂离子电池材料Li2MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2MSiO4有两种方法。
方法一:固相法,2Li2SiO3+FeSO4 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。
方法二:溶胶-凝胶法,CH3COOLi、Fe(NO3)3、Si(OC2H5)4等试剂 胶体
胶体 干凝胶
干凝胶 Li2FeSiO4。
Li2FeSiO4。
(1)固相法中制备Li2FeSiO4过程采用惰性气体气氛,其原因是
______________________________________________________________________。
(2)溶胶凝胶法中,检查溶液中有胶体生成的方法是________;生产中,生成1 mol Li2FeSiO4整个过程转移电子的物质的量为________mol。
(3)以Li2FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为Li+LiFeSiO4 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
(4)使用(3)组装的电池必须先________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质,分别设计了如图所示的原电池,请完成下列问题:
(1)①负极材料:
A池________,B池________。
②电极反应式:
A池:正极:________,负极:________
B池:正极:________,负极:________
(2)B池总反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)普通锌锰干电池的结构如图所示。回答下列问题。
①电池中电解质溶液为________。
②正极反应式为________。
③放电时,NH4+向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,原因是________________________。
若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
| A.微热 |
| B.加入适量氧化铜 |
| C.加入少量硫酸铜溶液 |
| D.加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是________________________________________________________________________。
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________________________________,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的FeO42-。实验过程中,两极均有气体产生,Y极区溶液逐渐生成FeO42-。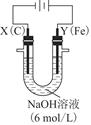
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和________________________________________________________________________,
若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com