
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是( )

A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器质量增加
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】在探索苯分子结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图所示),下列说法正确的是

A.五种物质均能与氢气发生加成反应
B.b、c、e的一氯代物均有三种
C.五种物质中,只有a分子的所有原子处于同一平面
D.a、b、c、e能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g) △H<0。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达 到平衡,测得容器中CO2的浓度为0.05molL-1 。
CO(NH2)2(s)+H2O(g) △H<0。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达 到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.气体的平均相对分子质量不随时间而变化 b.NH3和CO2的比例保持不变
c.气体的压强不再发生变化 d.2υ正(NH3)=υ逆(H2O)
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.24000kPa b.200℃ c.800℃ d.101 kPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
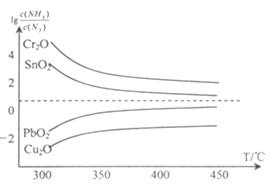
A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________(用等式表示)。
(4)能说明该反应已经达到平衡状态的是________。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________b(填“>”“=”或“<”),理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
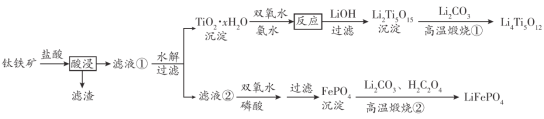
“酸浸”后,钛主要以![]() 形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com