
分析 (1)0.1mol•L-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)•c(OH-)计算溶液中c(H+),再根据pH=-logc(H+)计算溶液的pH值;
(2)溶液中存在亚铁离子的水解平衡和水的电离平衡;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离.
解答 解:(1)0.1mol•L-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故该溶液的pH=-log10-13=13,
故答案为:13;
(2)溶液中存在亚铁离子的水解平衡和水的电离平衡离子方程式为Fe2++2H2O?Fe(OH)2+2H+、H2O?OH-+H+;
故答案为:Fe2++2H2O?Fe(OH)2+2H+、H2O?OH-+H+;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:丙>甲=乙,
故答案为:丙>甲=乙.
点评 本题综合考查酸碱混合的定性判断和计算以及弱电解质的电离和盐类的水解等知识,题目难度中等.答题时注意审题.注意掌握溶液酸碱性与溶液pH的关系结合图象进行判断是解答本题关键.


科目:高中化学 来源: 题型:选择题
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
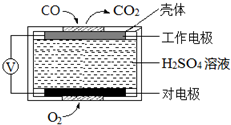 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.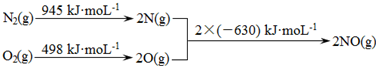
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 化学试 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )| A. | 重新达到平衡时,D的体积分数减小 | B. | a+b<c+d | ||
| C. | 平衡向右移动 | D. | 重新达到平衡时,A气体浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极上发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸的反应 OH-+H+═H2O | |
| B. | 氧化钙与稀盐酸反应 CaO+2H+═Ca2++H2O | |
| C. | 铁片插入硝酸银溶液中 Fe+Ag+═Fe2++Ag | |
| D. | 碳酸钙溶于稀硝酸中 CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com