
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
C. 元素W与Q的最高价氧化物对应的水化物的酸性W的强
D. 元素X与元素Z的最高正化合价之和的数值等于8
【答案】D
【解析】
该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
根据周期表的结构可推出元素分别为:X:N ; Y :O ; Z: Al ; W :S ; Q :Cl
A.同周期原子半径从左到右依次减小,同主族从上到下依次增大,B不正确。
B.离子Y2-和Z 3+都为10微粒,核外电子数和电子层数都相同。
C.元素最高价氧化物对应的水化物的酸性是与非金属性一致的,因此酸性Q的强。
D. 元素最高正化合价一般等于其主族数,所以D正确,答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,三种难溶银盐的Ksp与颜色如右表,下列说法正确的是
AgCl | Ag2CrO4 | AgI | |
颜色 | 白 | 砖红 | 黄 |
Ksp | 1.8×10-10 | 1.0×10-12 | 8.5×10-17 |
A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小
B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1
C.向AgCl悬浊液加入足量KI溶液,沉淀将由白色转化为黄色
D.向等浓度的KCl与K2CrO4混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
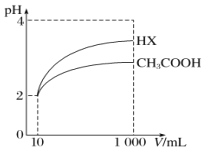
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废弃物的回收处理可以从源头上减少环境污染,不符合该理念的是
A. 废旧书刊焚烧处理 B. 废旧铅蓄电池回收金属铅
C. 将垃圾分类并回收处理 D. 废旧汽车回收钢铁和塑料等材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )
A.KCl
B.KCl和I2
C.KCl和Br2
D.KCl和KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,肯定能说明金属甲比金属乙金属性强的是( )
A.甲原子最外层电子数比乙原子最外层电子数少
B.甲原子电子层数比乙原子电子层数多
C.1mol甲从酸中置换生成的氢气比1mol乙从酸中置换生成的氢气多
D.常温下,甲能与水反应生成氢气,而乙不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,用 Fe2O3、 NiO 或 Cr2O3作催化剂对燃煤烟气进行回收,使 SO2转化生成为 S。催化剂不同,相同其他条件(浓度、温度、压强)情况下, 相同时间内 SO2 的转化率随反应温度的变化如下图:下列说法不正确的是( )
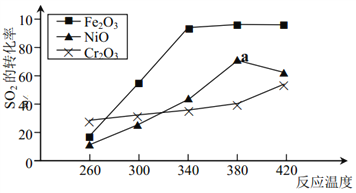
A. 不考虑催化剂价格因素,选择 Fe2O3 作催化剂可以节约能源
B. 相同其他条件下,选择 Cr2O3 作催化剂, SO2 的平衡转化率最小
C. a 点后 SO2 的转化率减小的原因可能是温度升高催化剂活性降低了
D. 选择 Fe2O3 作催化剂,最适宜温度为 340~380℃温度范围
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com