
【题目】一定温度下,在 2 L 密闭容器中,A、B、C 三种气体的物质的量随时间变化的曲线如图所示。下列说法正确的是( )
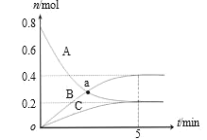
A.反应开始到 5min,υ(C)=0.2 mol/(L·min)
B.反应开始到 5min,B 的物质的量浓度增加了 0.4 mol/L
C.反应的化学方程式为:2B(g)+C(g)![]() 3A(g)
3A(g)
D.a 点时,c(A)=c(B)
【答案】D
【解析】
A.反应开始到5min,n(C)=0.2 mol,υ(C)= =0.02 mol/(L·min),A选项错误;
=0.02 mol/(L·min),A选项错误;
B.反应开始到5min,B的物质的量由0变为0.4mol,则增加了0.4mol,物质的量浓度增加了0.2mol/L,B选项错误;
C.反应达到平衡时,A的物质的量由0.8 mol减少为0.2 mol,变化量为0.6 mol,A为反应物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2 mol,变化量为0.2 mol,B、C为生成物,化学反应计量系数之比等于反应体系中物质变化量之比,n(A):n(B):n(C) =0.6 mol:0.4 mol:0.2 mol=3:2:1,则反应的化学方程式为:3A![]() 2B+C,C选项错误;
2B+C,C选项错误;
D.由图可知,a点时,A、B的物质的量相同,则物质的量浓度也相同,D选项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工领域具有重要的应用价值,可采用硼砂、SiO2、Na和H2作为原料制备。回答下列问题:
(1)周期表中,与B的化学性质最相似的邻族元素是____;该元素基态原子核外M层电子中自旋状态相同的有_____个。
(2)NaBH4中,电负性最大的元素是____(填元素符号);B的____杂化轨道与H的1s轨道形成![]() 键。
键。
(3)硼砂是含8个结晶水的四硼酸钠。其阴离子(含B、O、H三种元素)的球模型如图所示:
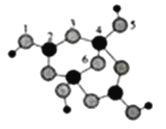
①阴离子中,配位键存在于____和____原子之间。(均填原子的序号)
②硼砂的化学式为_______。
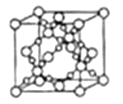
(4)SiO2晶胞(立方体)如图所示,已知SiO2的密度为![]() g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
g/cm3,设阿伏加德罗常数的值为NA,则SiO2晶胞的边长为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
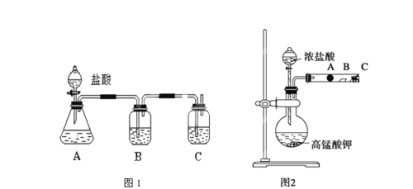
(1)根据实验图1作答:
①写出选用试剂分别 B__________,C____________
②装置B中所盛试剂的作用为_________
③C中反应的离子方程式为_______
④从实验所得非金属性C____Si(填“大于”或“小于”)
(2)根据实验图2作答:
①写出 A处的离子方程式:_______
②B处的现象_____
③C处药品的作用 _______。
④通过图2 装置实验得出同主族元素性质的递变规律为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W 为五种短周期元素,X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15;X 与 Z 可形成 XZ2 分子;Y 与 M 形成的气态化合物在标准状态下的密度为 0.76 g·L-1;W 的质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( )
A.原子半径:W>X>Y>Z>M
B.XZ2、X2M2、W2Z2 均为直线形的共价化合物
C.CaM2 和 CaZ2 两种化合物中,阳离子与阴离子个数比均为 1∶2
D.由 X、Y、Z、M 四种元素共同形成的化合物中一定有共价键,可能有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氢氧燃料电池,下列说法正确的是( )

A.用 KOH 做电解质,负极反应是 H2-2e-+2OH-=2H2O
B.电子从 a 电极通过外电路到 b 电极最终移到 a 电极形成闭合回路
C.原电池不能将化学能百分之百转化成电能
D.氢氧燃料电池在使用过程中会看到淡蓝色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如下图所示。下列说法不正确的是

A. 通过该催化反应,实现了太阳能向化学能的转化
B. 反应I中涉及到非极性键的断裂和极性键的形成
C. 反应II为:2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
D. 总反应为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取I2。
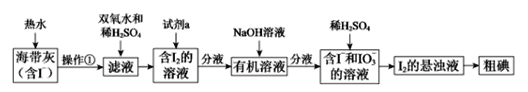
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是___。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是__________。
(3)试剂a可以是_________(填序号)。
A 酒精 B 四氯化碳
C 裂化汽油 D 苯
(4)I-和IO3-在酸性条件下生成I2的离子方程式是__________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com