
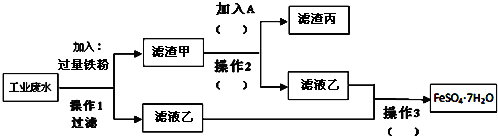
·ÖĪö ¹¤Ņµ·ĻĖ®ÖŠŗ¬“óĮæĮņĖįŃĒĢś”¢Cu2+ŗĶÉŁĮæµÄNa+£¬“ÓøĆ·ĻĖ®ÖŠ»ŲŹÕĮņĖįŃĒĢśŗĶ½šŹōĶ£¬½įŗĻĮ÷³ĢæÉÖŖ£¬¼ÓČėĢś·Ū£¬æÉÖĆ»»³öĶ£¬Ķ¬Ź±Éś³ÉĮņĖįŃĒĢś£¬²Ł×÷¢ńĪŖ¹żĀĖ£¬ŌņĀĖŅŗŅŅÖŠÖ÷ŅŖŗ¬ĮņĖįŃĒĢś£¬ĀĖŌü¼×ÖŠŗ¬Cu”¢Fe£¬¼ÓČėAĪŖH2SO4£¬²Ł×÷2ĪŖ¹żĀĖ£¬µĆµ½ĀĖŌü±ūĪŖCu£¬ĀĖŅŗÖŠÖ÷ŅŖŗ¬FeSO4£¬²Ł×÷3ĪŖÕō·¢”¢ÅØĖõ”¢½į¾§”¢¹żĀĖ£¬æɵƵ½FeSO4.7H2O£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗ¹¤Ņµ·ĻĖ®ÖŠŗ¬“óĮæĮņĖįŃĒĢś”¢Cu2+ŗĶÉŁĮæµÄNa+£¬“ÓøĆ·ĻĖ®ÖŠ»ŲŹÕĮņĖįŃĒĢśŗĶ½šŹōĶ£¬½įŗĻĮ÷³ĢæÉÖŖ£¬¼ÓČėĢś·Ū£¬æÉÖĆ»»³öĶ£¬Ķ¬Ź±Éś³ÉĮņĖįŃĒĢś£¬²Ł×÷¢ńĪŖ¹żĀĖ£¬ŌņĀĖŅŗŅŅÖŠÖ÷ŅŖŗ¬ĮņĖįŃĒĢś£¬ĀĖŌü¼×ÖŠŗ¬Cu”¢Fe£¬¼ÓČėAĪŖH2SO4£¬²Ł×÷2ĪŖ¹żĀĖ£¬µĆµ½ĀĖŌü±ūĪŖCu£¬ĀĖŅŗÖŠÖ÷ŅŖŗ¬FeSO4£¬²Ł×÷3ĪŖÕō·¢”¢ÅØĖõ”¢½į¾§”¢¹żĀĖ£¬æɵƵ½FeSO4.7H2O£¬
£Ø1£©¼ÓČėĢś·Ū£¬ĢśÖĆ»»³öĶ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖFe+Cu2+=Fe2++Cu£¬Ģś”¢ĶµÄ»ģŗĻĪļÖŠ¼ÓČėĻ”ĮņĖį£¬ĢśÓėĻ”ĮņĖį·“Ӧɜ³ÉĮņĖįŃĒĢśŗĶĒāĘų£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖFe+2H+=Fe2++H2”ü£¬
¹Ź“š°øĪŖ£ŗFe+Cu2+=Fe2++Cu£» Fe+2H+=Fe2++H2”ü£»
£Ø2£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖĀĖŌü¼×ŗ¬ÓŠFe”¢Cu£¬ĀĖŅŗŅŅŗ¬ÓŠFeSO4£¬ĀĖŌü±ūĪŖCu£¬¹Ź“š°øĪŖ£ŗFe”¢Cu£»FeSO4£»Cu£»
£Ø3£©²Ł×÷2ÓĆÓŚ·ÖĄė¹ĢĢåŗĶŅŗĢ壬ĪŖ¹żĀĖ²Ł×÷£¬²Ł×÷3ÓÉČÜŅŗÖŠµĆµ½¾§Ģ壬æɽųŠŠÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬¹Ź“š°øĪŖ£ŗ¹żĀĖ£»Õō·¢ÅØĖõ”¢ĄäČ“½į¾§£»
£Ø4£©²Ł×÷1ĪŖ¹żĀĖ²Ł×÷£¬ÓƵ½²£Į§°ō”¢ĘÕĶØĀ©¶·£¬¹Ź“š°øĪŖ£ŗ²£Į§°ō£»ĘÕĶØĀ©¶·£®
£Ø5£©¼ģŃéFe3+£¬æÉȔɣĮæAČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó1-2µĪĮņĒč»Æ¼ŲČÜŅŗ£¬ČōČÜŅŗ±äĪŖŃŖŗģÉ«£¬ŌņĖµĆ÷ČÜŅŗAÖŠŗ¬ÓŠFe3+£¬
¹Ź“š°øĪŖ£ŗȔɣĮæAČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó1-2µĪĮņĒč»Æ¼ŲČÜŅŗ£¬ČōČÜŅŗ±äĪŖŃŖŗģÉ«£¬ŌņĖµĆ÷ČÜŅŗAÖŠŗ¬ÓŠFe3+£®
µćĘĄ ±¾Ģāæ¼²é»ģŗĻĪļµÄ·ÖĄė”¢Ģį“棬²ąÖŲ·ÖĄėĮ÷³ĢŗĶ·ĻĖ®“¦ĄķµÄ漲飬ĪŖøßĘµæ¼µćŗĶ³£¼ūĢāŠĶ£¬°ŃĪÕĮ÷³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦¼°·ÖĄė·½·ØĪŖ½ā“šµÄ¹Ų¼ü£¬×¢ÖŲ»ł“”ÖŖŹ¶µÄ漲飬ĢāÄæÄŃ¶Č²»“ó£®


 ¾ŁŅ»·“Čżµ„ŌŖĶ¬²½¹ż¹Ų¾ķĻµĮŠ“š°ø
¾ŁŅ»·“Čżµ„ŌŖĶ¬²½¹ż¹Ų¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ŹĒĻņČŻĮæĘæ×ŖŅĘČÜŅŗ | |
| B£® |  ÖĘČ”ĒāŃõ»ÆŃĒĢś | |
| C£® |  ŹĒĢ¼ĖįĒāÄĘŹÜČČ·Ö½ā | |
| D£® |  ·ÖĄėĖÄĀČ»ÆĢ¼£Ø·Šµć76.75”ę£©ŗĶ¼×±½£Ø·ŠµćĪŖ110.6”ę£©µÄ»ģŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ö»ÓŠ¢Ł¢Ś | B£® | Ö»ÓŠ¢Ś¢Ū | C£® | Ö»ÓŠ¢Ł¢Ū | D£® | ¶¼ÕżČ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
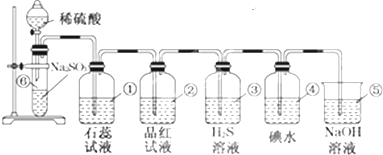
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ü | B£® | ¢Ł¢Ś¢Ū | C£® | ¢ŪŗĶ¢Ü | D£® | ¢ŁŗĶ¢Ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒ×¢ÉäŅŗ²»ÄܲśÉś¶”“ļ¶ūĻÖĻó£¬ĖłŅŌĖü²»ŹōÓŚ½ŗĢå | |
| B£® | ŃĪĀ±æÉÓĆÓŚÖʶ¹øÆ | |
| C£® | Ć÷·ÆæÉÓĆÓŚĖ®µÄĻū¶¾”¢É±¾ś | |
| D£® | Ģ¼ĖįĒāÄĘÄÜÓĆÓŚÖĪĮĘĪøĖį¹ż¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
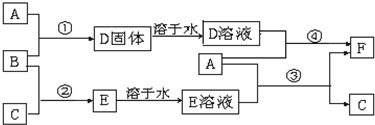
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 molŅŗĢ¬ėĀŌŚ×ćĮæŃõĘųÖŠĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘų£¬·Å³ö642 kJµÄČČĮæ£ŗN2H4£Øl£©+O2£Øg£©ØTN2£Øg£©+2H2O£Øg£©”÷H=+642 kJ•mol-1 | |
| B£® | C2H6µÄČ¼ÉÕČČĪŖQ kJ•mol-1£¬Ōņ±ķŹ¾C2H6Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ2C2H6£Øg£©+7O2£Øg£©ØT4CO2£Øg£©+6H2O£Øl£©”÷H=-2Q kJ•mol-1 | |
| C£® | ŅŃÖŖ£ŗH2£Øg£©+$\frac{1}{2}$O2£Øg£©ØTH2O£Øl£©”÷H=-286 kJ•mol-1£¬Ōņ£ŗ2H2O£Øl£©ØT2H2£Øg£©+O2£Øg£©µÄ”÷H=+572 kJ•mol-1 | |
| D£® | ŅŃÖŖN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.4 kJ•mol-1£¬ŌņŌŚŅ»¶ØĢõ¼žĻĀĻņĆܱÕČŻĘ÷ÖŠ³äČė0.5 mol N2£Øg£©ŗĶ1.5 mol H2£Øg£©³ä·Ö·“Ó¦·Å³ö46.2 kJµÄČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | O2£¾I2£¾S | B£® | H2S£¾NaI£¾H2O | C£® | S£¾I2£¾O2 | D£® | H2O£¾NaI£¾H2S |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com