
【题目】红磷(P)和白磷(P4)均为磷的同素异形体。已知:
P4(s)+5O2(g)=P4O10(s) △H=-2983.2kJ/mol
P(s)+5/4O2(g)=1/4P4O10(s) △H=-738.5kJ/mol
写出白磷转化为红磷的热化学方程式 ,由此可知,红磷比白磷 。(填“稳定”或“不稳定”)
【答案】P4(s、白磷)=4P(s、红磷)△H=-29.2kJ/mol;稳定;
【解析】
试题分析:白磷转化为红磷的热化学方程式P4(s、白磷)=4P(s、红磷),可以看成是下列两个反应方程式的和:P4(白s)+5O2(g)═P4O10(s)△H═-2983.2kJ/mol;P (红s)+![]() O2(g)═
O2(g)═![]() P4O10(s)△H═-738.5kJ/mol;根据白磷转化为红磷的热化学方程式可知过程是一个放热反应,所以白磷具有的能量高于红磷,能量越低越稳定,所以红磷比白磷稳定,根据盖斯定律,白磷转化为红磷P4(s、白磷)=4P(s、红磷)的△H=-2983.2kJ/mol+2954kJmol-1=-29.2KJ/mol,故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol;稳定。
P4O10(s)△H═-738.5kJ/mol;根据白磷转化为红磷的热化学方程式可知过程是一个放热反应,所以白磷具有的能量高于红磷,能量越低越稳定,所以红磷比白磷稳定,根据盖斯定律,白磷转化为红磷P4(s、白磷)=4P(s、红磷)的△H=-2983.2kJ/mol+2954kJmol-1=-29.2KJ/mol,故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol;稳定。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
【查阅资料】1、无水FeCl3在空气中易潮解,加热易升华。
2、氯气(Cl2)是一种有毒的黄绿色气体,能与NaOH溶液反应。
【实验探究】学习小组设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
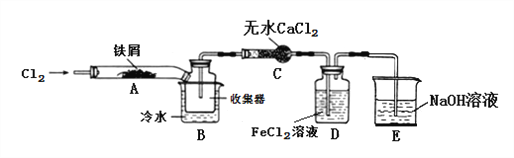
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为:______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是:____________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填操作步骤序号)____________。
(4)装置D中FeCl2溶液全部反应后,因失去吸收Cl2的作用而失效,写出证明FeCl2溶液已经失效的操作方法:________________。
(5)该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到黄色固体。请写出该反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4.6 g钠放入200 mL 0.1 mol·L-1 AlCl3溶液中,待其充分反应后,下列叙述中正确的是 ( )
A. Cl-的浓度几乎不变
B. 溶液变浑浊
C. 溶液中Al3+全部转化为AlO![]()
D. 溶液中存在最多的离子是Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )
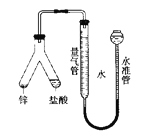
A.用CCl4代替水,测得氢气的体积更准确
B.量气管压入漏斗的水过多而溢出,会导致测定失败
C.必须待体系温度降低到0℃时才可进行读数
D.上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的温度和压强下,4个相同体积的密闭容器中分 别装有4种气体.则4个容器中气体的质量最大是( )
A.CO2 ,
B.O2
C.N2
D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 铝与氢氧化钠溶液反应 :2Al +2 OH-=2AlO2-+3H2O
B. 将磁性氧化铁溶于盐酸:![]()
C. 用氢氧化钠溶液除去铝表面的氧化膜:![]()
D. 过氧化钠溶于盐酸:Na2O2+2H+=2Na++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1[
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,
则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com