
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等物质的量浓度的盐酸、硅酸的pH | 盐酸的pH小于硅酸的pH | 非金属性:Cl>Si |
| B | 取待测液于试管中,加一颗绿豆大的钠粒 | 有气体生成 | 检验乙酸溶液中是否混有乙醇 |
| C | 向FeI2溶液中加入少量苯,然后再通入少量Cl2 | 下层液体呈浅绿色,上层液体呈紫红色 | 还原性:I->Fe2+ |
| D | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液中 | 产生白色沉淀 | X可能是NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
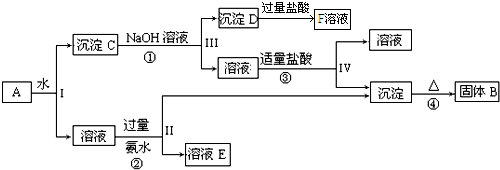
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
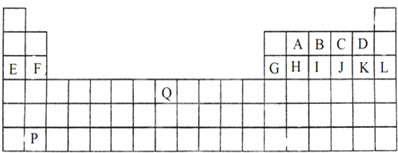
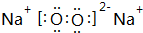 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中溶液能电离出自由移动的离子 | |
| B. | 电极上进行的氧化还原反应的生成物为电子 | |
| C. | 有两根导线将两个活泼性不同的电极连接 | |
| D. | 电极上进行的氧化还原反应中发生了电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
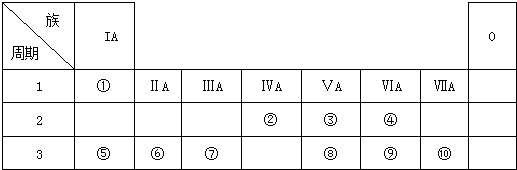
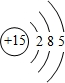 ;
;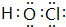
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com