
【题目】二甲基砜是合成人体胶原蛋白的必要物质。实验室用二甲基硫醚为原料合成二甲基砜的新方法为:
反应 i:(CH3)2S+H2O2→(CH3)2SO+H2O
反应 ii: 。
二甲基硫醚(CH3)2S | 二甲基亚枫(CH3)2SO | 二甲基砜(CH3)2SO2 | |
密度 | 0.85 g·cm-3 | 1.10 g·cm-3 | —— |
熔点/沸点 | -83.2℃/37.5℃ | 18.4℃/189℃ | 111℃/238℃ |
溶解性 | 不溶于水 | 易溶于水、乙醇 | 易溶于水、乙醇 |
具体流程如下:
![]()
回答下列问题:
(1)反应装置如图所示,仪器 B 的名称是_____,其作用是_____。
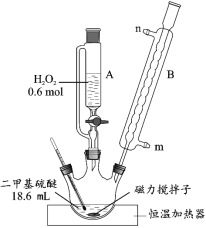
(2)第①步反应温度不高于 40 ℃的原因是_____;该步骤反应完全的现象是_____。
(3)第②步先将 A 中滴加剩余的 H2O2 全部加入三颈烧瓶中,然后加热发生反应 ii。该反应的化学方程式为_____。
(4)第③步的实验操作为_____、过滤、低温干燥,得到二甲基砜产品。
(5)二甲基砜传统的生产工艺是由 HNO3 氧化(CH3)2S 生成(CH3)2SO,然后用 NaOH 中和、精馏,制得精品(CH3)2SO,最后再经氧化制得(CH3)2SO2。该新方法与传统硝酸氧化法比的优点有_____(至少回答 2 点)。
(6)该实验中制得二甲基砜 19.176g。二甲基砜的产率为_____。
【答案】球形冷凝管 冷凝回流 防止反应过于剧烈,并能减少二甲基硫醚的挥发和双氧水的分解 溶液不分层 ![]() 冷却结晶 试剂少、步骤少、杂质少、污染少、条件易控制等合理答案 80%
冷却结晶 试剂少、步骤少、杂质少、污染少、条件易控制等合理答案 80%
【解析】
由题中信息可知,二甲基硫醚和双氧水在一定的条件下发生反应可以生成二甲基亚枫和二甲基砜,反应分两步进行,通过控制温度得以实现。充分反应后,冷却结晶、过滤、低温干燥,得到二甲基砜产品。
(1)仪器 B是球形冷凝管。由于二甲基硫醚的沸点为37.5℃,易挥发,因此,冷凝管的作用是冷凝回流;
(2)由表可知二甲基硫醚的沸点为37.5℃,控制温度在40摄氏度以下为了减少二甲基硫醚的挥发,双氧水受热易分解,控制较低的温度有利于减少双氧水分解,另外,控制较低的温度也有利于控制化学反应速率,防止反应过于剧烈;二甲基硫醚不溶于水,二甲基亚砜溶于水,则反应结束后溶液不分层,故答案为:防止反应过于剧烈,并能减少二甲基硫醚的挥发和双氧水的分解;溶液不分层;
(3)二甲基亚砜(CH3)2SO和H2O2反应生成二甲基砜(CH3)2SO2,反应条件为120℃,化学方程式为:![]() ;
;
(4)二甲基砜(CH3)2SO2的熔点为111℃,防止二甲基砜熔化,应采用冷却结晶法,故答案为:冷却结晶;
(5)相比传统方法,新方法试剂少、步骤少、杂质少、污染少、条件易控制;
(6)二甲基硫醚物质的量为![]() ,由方程式可知关系式为:
,由方程式可知关系式为:![]() ,则二甲基砜理论产量为
,则二甲基砜理论产量为![]() ,产率=
,产率=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是 ( )
A. ![]() 有3种官能团
有3种官能团
B. 三元轴烯(![]() )与苯互为同分异构体
)与苯互为同分异构体
C. 乙苯分子中最多有7个碳原子在同一平面上
D. 烷烃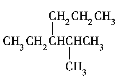 的正确命名是2甲基3丙基戊烷
的正确命名是2甲基3丙基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.向氨水中通入过量SO2:NH3·H2O+SO2=NH4++HSO3-
B.Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+H2↑
C.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是

A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置制备 NH3 并探究其性质。下列说法正确的是

A.①中固体可换为 NH4Cl
B.②中药品为 P2O5
C.反应一段时间后,③中黑色固体变为红色
D.反应一段时间后,④中锥形瓶收集到液氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
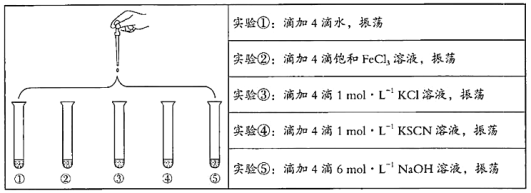
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:

(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下可实现下图所示物质之间的转化:
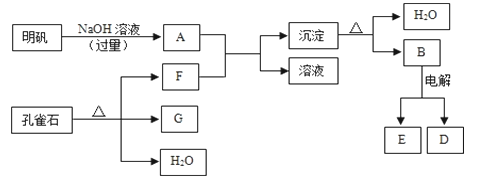
请填写下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是______(填化学式)。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:_________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式_______,该反应消耗了3 molG,则转移的电子数是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com