
 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,生成沉淀量随NaOH溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液:NH4+、Fe2+、Cl-、NO3- | |
| B. | b点对应的溶液:K+、Cl-、SCN-、MnO4- | |
| C. | c点对应的溶液:K+、Fe2+、Br-、NO3- | |
| D. | d点对应的溶液:Ba2+、HCO3-、Cl-、NO3- |
分析 向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,先发生酸碱中和反应,则图中a点显酸性,b点硫酸恰好完全反应,c点时溶质为硫酸钠,d点时溶质为偏铝酸钠,结合离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,不能结合生成络离子等,则离子大量共存,以此来解答.
解答 解:向一定量的硫酸、硫酸铝、硫酸铁的混合溶液中逐滴加入NaOH溶液,先发生酸碱中和反应,则图中a点显酸性,b点硫酸恰好完全反应,c点时溶质为硫酸钠,d点时溶质为偏铝酸钠,
A.a点对应的溶液中H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.b点对应的溶液中Fe3+、SCN-结合生成络离子,不能大量共存,故B错误;
C.c点对应的溶液为中性,且该组离子之间不反应,可大量共存,故C正确;
D.d点对应的溶液,Ba2+、SO42-结合生成沉淀,Al02-促进HCO3-的电离,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、络合反应的离子共存考查,注意反应的先后顺序及各点溶液的酸碱性,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
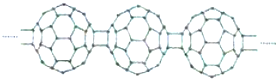
| A. | C60转变为X是物理变化 | B. | X中含积极性共价键 | ||
| C. | X与金刚石互为同位素 | D. | X能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 离子半径:W3+>Y2->Z+ | D. | 单质沸点:W>X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

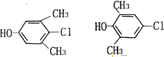 (写两种)
(写两种) 的化学方程式
的化学方程式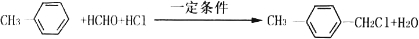 ,
,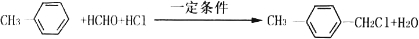 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与乙酸乙酯的混合物,可通过蒸馏或用足量饱和碳酸钠溶液洗涤后分液的方法进行分离 | |
| B. | 做金属钠和水反应实验时,切割下来的表层物质,也不能直接丢弃到废纸篓里,而应放回原试剂瓶 | |
| C. | 酸式滴定管在润洗时,可在滴定管中加入少量待装液,润洗后将溶液从滴定管的上口倒入废液缸中,重复2~3次,润洗完毕 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取,蒸馏,分液 | B. | 分液,萃取,蒸馏 | C. | 蒸馏,萃取,分液 | D. | 分液,蒸馏,萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
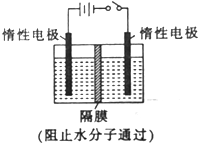 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某无色稀溶液X中,可能含有表所列离子中的某几种.
某无色稀溶液X中,可能含有表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2- | |
| B. | 若Y是盐酸,则溶液中可能含有的阳离子是Al3+ | |
| C. | 若Y是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 若Y是NaOH溶液,则X溶液中只存四种离子是:Al3+、Fe3+、NH4+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com