
����Ŀ�������������Ѿ�(ֻ���ǵĴ���Ȼ��Ʒ�)���׳����⣬�б���˵�������������ѾƲ��ʧ������Ҫԭ���Ƿ����̲����ľ��ֶ����֣����Կ��ƣ������������ж��ļ״������ʡ���ѧ��Ƽ�SO2�ȸ��ϡ��ҹ����ұ���GB2760-2014���涨���Ѿ���SO2�IJ�������0.25g/L��
(1)���Ѿ�������SO2�����ÿ�����________��
A.����ϸ�� B.������ C.Ư�� D.��������
I.ʵ�鷽��һ
����SO2��Ư���Լ��ɰ����Ѿ�(Һ��Ϊ��ɫ)�е�SO2��HSO3�������ͼ1��ʵ��:
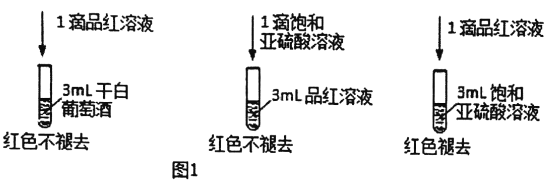
(2)��ͬѧ�ó�ʵ�����: �ɰ����Ѿ��в���SO2��HSO3����������Ƿ����?˵������_________��
��.ʵ�鷽����
��ͼ2����ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������

(3)�رյ��ɼ�2�����ɼ�1��ע����������ûƿ�й��壬д��Cװ�÷�Ӧ�ķ���ʽ______��ÿ����1molNa2O2����ת�Ƶ�����___________��
(4)�رյ��ɼ�1���ɼ�2�������������E��F�У�Ϊ��֤��SO2�л�ԭ�ԣ�������ɫ��ѧ�ĽǶȿ��ǣ���Z�Լ�������___________��������___________��
��.ʵ�鷽����
�õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ��ͼ3 װ��(�缫��Ϊ���Բ���) ����ʵ�飬�������Ʊ����ᣬͬʱ��õ���:

(5)M�������ĵ缫��ӦʽΪ__________��N������ҺpH______(���С������)��
(6)��ʹ��װ�õĵ���ǿ�ȴﵽ2.0A��������8 ����Ӧ��ͨ���״������������Ϊ___L (��֪: 1��e��������Ϊ1.6��10-19C������٤������6��1023)��
���𰸡� BD ��������ʵ��Ա�˵��Ũ�ȵ͵��������ʹƷ����ɫ�����Ѿ��е�SO2�����ܵͣ�����Ҳ����ʹƷ����ɫ SO2+Na2O2=Na2SO4 2NA ����KMnO4 ��ɫ��Һ��dz����ɫ(FeCl3��Һ����Һ���ػ�ɫ��Ϊdz��ɫ) SO2+2H2O-2e-=SO42-+4H+ ��� 0.112
��������(1)����������н�ǿ�Ļ�ԭ�ԣ����Է�ֹ���ѾƱ����������������ˮ��Һ�����ԣ�������ǿ���ѾƵ����ԣ�����������Ư���ԣ�����������ĺ������٣�û�н����Ѿ�Ư�ף���ѡBD��
I.(2)1�α�����������Һ����3mLƷ����Һ�в���ɫ����1��Ʒ����Һ����3mL������������Һ����ɫ��˵�����������������ĺ�����Ӱ��Ư��Ч�����ɰ����ѾƲ���ʹƷ����Һ��ɫ��ԭ��Ϊ���ɰ��ж�������������Ậ��̫�٣��ʴ�Ϊ����������ʵ��Ա�˵��Ũ�ȵ͵��������ʹƷ����ɫ�����Ѿ��е�SO2�����ܵͣ�����Ҳ����ʹƷ����ɫ��
��ʵ�鷽������װ��A���Ʊ���������X�����������C�м���SO2��Na2O2��Ӧ�Ƿ���������D������������Һ����ʣ��Ķ�������ֹ��Ⱦ������Eװ����֤��������Ļ�ԭ�ԣ�Fװ����֤��������Ϊ�������壬�����ն�������ֹ��Ⱦ������
(3)�رյ��ɼ�2�����ɼ�1��ע����������ûƿ�й��壬Aװ��������������Ũ���ᷴӦ�ų��������������������������Ʒ�Ӧ���������ƣ���Ӧ�ķ���ʽΪSO2+Na2O2=Na2SO4�����ݷ���ʽ��ÿ����1molNa2O2��ת��2mol���ӣ��ʴ�Ϊ��SO2+Na2O2=Na2SO4��2NA��
(4)�رյ��ɼ�1���ɼ�2�������������E��F�У�Ϊ��֤��SO2�л�ԭ�ԣ�������ɫ��ѧ�ĽǶȿ��ǣ���Z�Լ�ѡ������KMnO4��������ؾ���ǿ�����ԣ�����������ԭ��ɫ���ʴ�Ϊ������KMnO4����ɫ��Һ��dz����ɫ��
����(5)�����Ƕ�������������ˮ��Ӧ�������ᣬM�缫Ϊ������N�缫Ϊ������M�缫�϶�������ʧȥ������������SO42-������ԭ���غ�����غ��֪����ˮ�μӷ�Ӧ�������������ɣ��缫��ӦʽΪ��SO2+2H2O-2e -�TSO42-+4H+��N�缫�ķ�ӦʽΪO2 + 4e-- + 4H+ == 2H2O��N������ҺpH��ʴ�Ϊ��SO2+2H2O-2e -�TSO42-+4H+�����
(6)8����ת�Ƶ������ʵ���Ϊ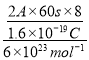 =0.01mol������Ҫ�����������Ϊ��
=0.01mol������Ҫ�����������Ϊ�� ![]() ��22.4L/mol��0.112L���ʴ�Ϊ��0.112��
��22.4L/mol��0.112L���ʴ�Ϊ��0.112��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������PPG����һ�ֿɽ���ľ�֬��߷��Ӳ��ϣ��ڲ��ϵ����������Է������õ�Ӧ��ǰ����PPG��һ�ֺϳ�·�����£� 
��֪��
����A����Է�������Ϊ70���˴Ź���������ʾֻ��һ�ֻ�ѧ��������
�ڻ�����BΪ���ȴ�����������C�ķ���ʽΪC5H8
��E��FΪ��Է���������14��ͬϵ�F�Ǹ������յ�����
��R1CHO+R2CH2CHO ![]()
![]()
�ش��������⣺
��1��A�Ľṹ��ʽΪ ��
��2����B����C�Ļ�ѧ����ʽΪ ��
��3����E��F����G�ķ�Ӧ����Ϊ �� E�Ļ�ѧ����Ϊ ��
��4����D��H����PPG�Ļ�ѧ����ʽΪ��
��5��D��ͬ���칹����ͬʱ�������������Ĺ����֣����������칹���� �����뱥��NaHCO3��Һ��Ӧ����Һ��
�ڼ��ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ�����к˴Ź���������ʾΪ3��壬�ҷ������Ϊ6��1��1��������д�ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ͬ��þ������������Һ��Ӧ����Ӧ��ʼʱ�ų�H2������
A.20mL4mol��L-1����B.10mL1mol��L-1��������Һ
C.10mL1mol��L-1����D.20mL1mol��L-1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����80�������T.R.Cech��S.Altman�ֱ����˾��д����ܵĺ�ø��������øֻ�ǵ����ʵĴ�ͳ���Ϊ��˫˫�����1989���ŵ������ѧ���� ����ø����ָijЩ �� ��
A��DNA B��RNA C��Ⱦɫ�� D��ATP
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ��Һ��Ҫ�ɷ�ΪSiO2��FeO��Fe2O3��Al2O3 �ȣ�Ϊ�ۺ����ã�����������´������Ʊ�Al2O3��(NH4)2Fe(SO4)2��6H2O��

����������£�
Kb(NH3��H2O) | 1.8��10-5 | �ܽ��/g | 10�� | 30�� | 50�� |
Ksp[A1(OH)3] | 1.3��10-33 | (NH4)2SO4 | 73.0 | 78.0 | 84.5 |
Ksp[Fe(OH)2] | 8.0��10-16 | FeSO4��7H2O | 40.0 | 60.0 | |
Ksp[Fe(OH)3] | 4.0��10-38 | |(NH4)2Fe(SO4)2��6H2O | 18.1 | 24.5 | 31.3 |
��1����������в�������������Ҫ�ɷ���_______________��
��2����Һ���м������۵�������__________________��
��3����֪���백ˮǰ����Һ��H+��Fe2+��Al3+��Ũ�ȷֱ�Ϊ0.02 mol/L��0.16mol/L��0.04mol/L�����˰�ˮ����Һ������պ�����1����Ϊ��ֹFe2+ ��������������Һ�е�pH���ܳ���_______����ʱ��Һ��n(NH3��H2O)��n(NH4+)��_____________����������ҺpHΪ5������Һ���������ӵ����ʵ���Ũ���ɴ�С���е�˳����_________________��
��4������Һ���Ʊ�(NH4)2Fe(SO4)2��6H2O ����ʱ��Ϊ��ֹ��(NH4)2SO4��FeSO4������������������Һ���м���������______________��������Ũ����__________�����ˡ�__________�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��о����ԣ�ҩ������ʳ������������������Ԫ�أ��С�����Ԫ�ء�֮�ƣ�����ʳ���к���϶���ǣ�������
A.����
B.��֭
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL ϡHNO3��ϡH2SO4��ɵĻ����Һ�У�����������ʵ���Ũ��֮��Ϊ0.4mol/L�������Һ�м���������ͭ�ۺ���ȣ���ַ�Ӧ��������Һ��Cu2+�����ʵ���Ũ�����ֵΪ����Ӧǰ����Һ����仯���Բ��ƣ�
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���Ƿ���ȷ�������� �� ![]() ������1��3��������2����ϩ
������1��3��������2����ϩ
����Է���������ͬ�������л���һ����ͬ���칹��
��ϩ����ͬϵ����̼���������������
�ܴ�ú�����з���������ױ������ױ����л���Ĺ���Ϊ��ѧ�仯
������ͬ�����£�ȼ�յ�������C2H4�ͱ�����ϩ����O2������
�ޱ���Ȳ�������6��ԭ����ͬһ��ֱ���ϣ�
A.������ȷ
B.�ۢݢ���ȷ
C.�ڢܢ���ȷ
D.�٢ۢ���ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˷�Ӧ�����ܷ���Ҳ������Ԫ�ء�2016 ���������ȷ�ϣ�����ԭ�Ӻ˼��ײ���������ԭ�������ֱ�Ϊ113��115��117 ��118 ������Ԫ�أ����ĿǰԪ�����ڱ��Ŀհף�����113 ��Ԫ����Al Ԫ�ش���ͬһ���塣����˵����ȷ����
A.�˷�Ӧ����ʵ���˻�ѧ�ܵ����ܵ�ת��
B.115 ��Ԫ��һ���Ǵ���VA ��ķǽ���Ԫ��
C.117 ��Ԫ����F��Cl��Br��I������VIIA��
D.������Ԫ��λ��Ԫ�����ڱ��еIJ�ͬ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com