
下列表示正确的是
A.用盐酸和淀粉-KI试纸检验碘盐中的KIO3 : IO3-+5I-+6H+=3I2+3H2O
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0KJ/mol
C.Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D.在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,阴离子种数减少3种,则原溶液中一定有CO32-
A
【解析】
试题分析:A.符合反应事实,拆写符合离子方程式的原则,正确;B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+566.0KJ/mol,错误;C. Fe(OH)3溶于氢碘酸,发生氧化还原反应:2Fe(OH)3 +2I-+ 6H+ = I2+ 2Fe2+ + 6H2O,错误;D. 在某钠盐溶液中含有等物质的量的Cl-、I-、AlO2-、CO32-、NO3-、SiO32-中若干种,当加入过量的盐酸产生气泡,溶液颜色变深,说明含有I-;阴离子种数减少3种,则原溶液中可能有CO32-、、NO3-;还含有AlO2-,错误。
考点:考查离子方程式和热化学方程式的正误判断、离子检验和离子共存的知识。


科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
B.向 NaHSO4溶液中滴加Ba(OH)2溶液至中性: H++SO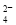 +Ba2++OH-
+Ba2++OH- BaSO4↓+H2O
BaSO4↓+H2O
C.用氯化铁溶液腐蚀铜板:Cu+Fe3+===Cu2++Fe2+
D.用烧碱溶液吸收氯气:Cl2+2OH-==Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:选择题
十八大报告中提到要加快生态文明建设的步伐,下列措施有利于生态文明建设的是:①研发易降解的生物农药 ②开发生产无汞电池 ③田间焚烧秸秆 ④应用高效洁净的能转换技术 ⑤加快化石燃料的开采与使用
A.①③⑤ B.①②④ C.②③⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是

A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸
B.第②步中结晶出的MgCl2·6H2O可在蒸发皿中加热制无水MgCl2
C.在第④步中的反应离子方程式为Br2+SO2+2H2O=2H+ +SO42-+2HBr
D.第⑤步涉及的分离操作有过滤、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
A.Mg2+、Cl-、Na+、NO3- B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3- D.Fe3+、Na+、AlO2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
下列物质之间的转化都一步能实现的是
A.Si→SiO2→H2SiO3→Na2SiO3 B.Al→Al2O3→Al(OH)3→NaAlO2
C.Na→NaOH→Na2CO3→NaHCO3 D.Cu→CuO→Cu(OH)2→CuSO4
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水的混合液,分离它们的正确方法依次是
A.分液、蒸馏 B.萃取、分液 C.分液、萃取 D.蒸馏、分液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)  2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com