
下列离子方程式正确的是 ( )
A.铁粉和氯化铁溶液反应 Fe + 2Fe3+ → 3Fe2+
B.铁和稀盐酸反应 2Fe + 6H+ → 2Fe3+ + H2↑
C.硫化亚铁溶于稀硝酸中:FeS + 2H+ → Fe2++ H2S↑
D.铝和氢氧化钠溶液反应 2Al + 2OH- → 2AlO2- + 3H2↑
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
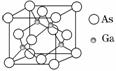 砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
砷化镓广泛用于雷达、电子计算机、人造卫星,宇宙飞船等尖端技术中。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
(1)砷化镓的化学式为____________。
(2)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________(用氢化物分子式表示)。
(3)比较二者的第一电离能:As________(填“<”“>”或“=”)Ga。
(4)下列说法正确的是________(填字母)。
A.砷化镓晶胞结构与NaCl相同
B.砷化镓晶体中与同一个镓原子相连的砷原子构成正四面体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律不正确的是 ( )
A.钠、镁、铝单质还原性依次减弱 B.碘、溴、氯单质氧化性依次增强 C.C、N、O原子半径依次减小 D.N、O、F最高正价依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为 ( )
A.6∶1 B.3∶1
C.2∶1 D.1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
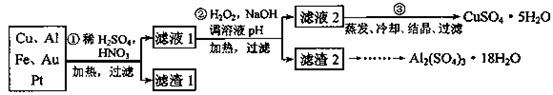
某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 2.2 | 3.2 |
| Al3+ | 3.7 | 4.7 |
| Cu 2+ | 5.6 | 6.4 |
回答下列问题:
①第①步参加反应的金属有 。
②第②步加入H2O2是因为滤液1中含有 离子。使用H2O2的优点是 。
③用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是: 。
④请帮助化学小组的同学完成由滤渣2制取Al2(SO4) 3·18H2O 的实验步骤:
(1)取滤渣2,加入足量的 ,充分反应后过滤;
(2)取滤液,加入足量的 (填写试剂的化学式),然后过滤洗涤;
(3)用适量稀硫酸溶解;
(4)最后经过 (填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)除去FeCl2溶液中的少量FeCl3,可加入________,反应的离子方程式为________________________________________________________________________;
(2)除去FeCl3溶液中的少量FeCl2,可加入________,反应的离子方程式为________________________________________________________________________;
(3)除去FeCl2溶液中的少量CuCl2,可加入________,反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com