
| A. | 氢氧化钠溶液 | B. | 稀硫酸 | C. | 盐酸 | D. | 稀硝酸 |
分析 选项中各物质的物质的量相同,由关系式2Al~2NaOH~3H2SO4~6HCl~3H2↑计算,而硝酸具有强氧化性,与Al反应不生成氢气,以此进行解答.
解答 解:硝酸具有强氧化性,与Al反应不生成氢气,设NaOH、H2SO4、HCl的物质的量均为6mol,
由2Al~2NaOH~3H2SO4~6HCl~3H2↑可知,足量铝,酸、碱均完全反应,
所以6molNaOH反应生成9molH2,
6molH2SO4反应生成6molH2,
6molHCl反应生成3molH2,
所以物质的量相等时生成氢气最多的为氢氧化钠溶液,
故选A.
点评 本题考查物质的量的计算,题目难度中等,侧重学生分析能力和计算能力的考查,注意Al足量时酸碱完全反应及硝酸与Al不生成氢气为解答的关键,明确存在的关系式.


科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1K2SO4溶液中含有钾离子数为2NA | |
| B. | 0.1mol铁与0.1mol氯气点燃完全反应,转移电子数为0.3NA | |
| C. | 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA | |
| D. | 1L1mol•L-1氨水中,含有的NH3与NH3•H20分子的总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
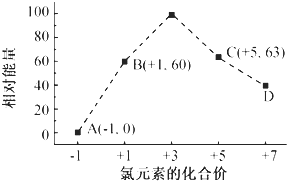 元素周期表的用途广泛.
元素周期表的用途广泛.| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
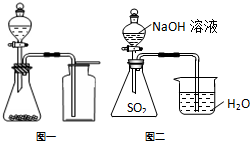
| A. | 氯气通入澄清石灰水中,制取漂白粉 | |
| B. | 可通过化合反应得到Fe(OH)3 | |
| C. | 选择合适的试剂,用图一所示装置可分别制取少量CO2、NO和O2 | |
| D. | 用图二的装置可证明SO2与NaOH发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质B的转化率增大 | B. | 平衡向正反应方向移动 | ||
| C. | 物质A的体积分数增大 | D. | a+b<m+n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12O的醇能够被催化氧化生成醛,该醇的同分异构体有4种 | |
| B. | 将苯、溴水和铁屑混合制溴苯 | |
| C. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,且互为同分异构体 | |
| D. | 若不考虑立体异构,分子式为C4H8O2且为酯的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 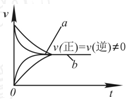 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 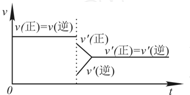 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com